Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Introducción
La enfermedad de Von Hippel-Lindau (VHL) es una afección de herencia autosómica dominante que predispone a las personas a múltiples neoplasias. Las variantes patogénicas germinales del gen VHL predisponen a las personas a presentar tipos específicos de tumores benignos, tumores malignos y quistes en muchos sistemas orgánicos. Entre estos, hemangioblastomas del sistema nervioso central; hemangioblastomas de retina; carcinomas renales de células claras y quistes renales; feocromocitomas, quistes, cistoadenomas y tumores neuroendocrinos de páncreas; tumores de saco endolinfático; y cistoadenomas de epidídimo (varones) y de ligamento ancho del útero (mujeres).[1,2,3,4] La evaluación, y en algunos casos, el tratamiento de estos pacientes con enfermedad de VHL exige un abordaje multidisciplinario. En determinadas circunstancias es útil contar con un profesional de enfermería encargado de la coordinación asistencial de casos para orientar a los pacientes durante la atención.[5] Entre los especialistas que atienden a las personas con VHL se encuentran cirujanos de oncología urológica, neurocirujanos, cirujanos generales, oftalmólogos, endocrinólogos, neurólogos, oncólogos médicos, asesores genéticos y genetistas médicos.
Referencias:
- Choyke PL, Glenn GM, Walther MM, et al.: von Hippel-Lindau disease: genetic, clinical, and imaging features. Radiology 194 (3): 629-42, 1995.
- Lonser RR, Glenn GM, Walther M, et al.: von Hippel-Lindau disease. Lancet 361 (9374): 2059-67, 2003.
- Pithukpakorn M, Glenn G: von Hippel-Lindau syndrome. Community Oncology 1 (4): 232-43, 2004.
- Glenn GM, Daniel LN, Choyke P, et al.: Von Hippel-Lindau (VHL) disease: distinct phenotypes suggest more than one mutant allele at the VHL locus. Hum Genet 87 (2): 207-10, 1991.
- Wolters WPG, Dreijerink KMA, Giles RH, et al.: Multidisciplinary integrated care pathway for von Hippel-Lindau disease. Cancer 128 (15): 2871-2879, 2022.
Características genéticas
GenVHL
El gen VHL es un gen supresor de tumores ubicado en en la citobanda 3p25-26 del brazo corto del cromosoma 3.[1] Las variantes patogénicas de VHL se presentan en los 3 exones de este gen. La mayoría de las personas afectadas por la enfermedad de VHL heredan una variante patogénica germinal del gen VHL de un progenitor afectado y una copia normal (natural) del gen VHL del progenitor no afectado. Los tumores asociados a la enfermedad de Von Hippel-Lindau (VHL) se ajustan a la hipótesis de Knudson de «doble golpe» o «doble lesión»,[2,3] según la cual, el origen clonal o la primera célula transformada del tumor aparece solo cuando se inactivan ambos alelos del gen VHL en una célula. La variante patogénica germinal del gen VHL heredada de un progrenitor corresponde al primer «golpe» o «lesión», y está presente en todas las células del cuerpo. El segundo «golpe» o «lesión» corresponde a una variante somática, que se presenta en un tejido específico en algún momento después del nacimiento. Esta lesión somática daña el alelo normal de VHL, y origina una célula neoplásica clonal inicial, que puede proliferar y formar una masa tumoral.
Prevalencia y efectos fundadores infrecuentes
La incidencia estimada de la enfermedad de VHL oscila entre 1 por 27 000 y 1 por 43 000 nacidos vivos en la población general.[4,5,6] La prevalencia estimada oscila entre 1 en 31 000 y 1 en 91 000 personas.[5,6,7,8] Es difícil obtener una cuantificación precisa de esta cifra porque exigiría detección sistemática exhaustiva en los familiares consanguíneos en riesgo de cada una de las personas con diagnóstico de enfermedad de VHL. El gran número de variantes patogénicas distintivas en este pequeño gen de 3 exones indica que la mayoría de los grupos familiares no se originaron en un solo fundador.
Penetrancia de variantes patogénicas
Las variantes patogénicas del gen VHL son muy penetrantes, se observan manifestaciones en más del 90 % de los portadores a la edad de 65 años.[4] Casi todos los portadores presentan uno o más tipos de neoplasias relacionadas con la enfermedad de VHL.
Factores de riesgo de la enfermedad de Von Hippel-Lindau
Cada uno de los descendientes (de ambos sexos) de una persona con enfermedad de VHL tiene una probabilidad del 50 % de heredar el alelo con la variante patogénica de VHL del progenitor afectado. Para obtener más información, consultar la sección Diagnóstico genético de la enfermedad de Von Hippel-Lindau.
Correlaciones entre genotipo y fenotipo
Las alteraciones específicas en el gen VHL a veces ayudan a predecir el riesgo individual de carcinoma de células renales (RCC) y otros tumores asociados a VHL. La clasificación de los pacientes en grupos de riesgo a partir de los genotipos ha sido un objetivo útil para informar la detección de las manifestaciones de la enfermedad de VHL. Se han hecho intentos para subdividir a los pacientes de acuerdo a las variantes familiares. Por ejemplo, en 1991, los investigadores clasificaron los casos de VHL en 2 tipos diferentes: VHL de tipo 1 (VHL sin feocromocitomas) y VHL de tipo 2 (VHL con feocromocitomas).[7] Las personas con VHL de tipo 1 a menudo tienen deleciones grandes del gen VHL, mientras que las personas con VHL de tipo 2 a menudo tienen variantes de cambio de sentido en el gen VHL.[9,10] En 1995, la enfermedad de VHL de tipo 2 se subdividió en VHL de tipo 2A (VHL con feocromocitomas y riesgo bajo de RCC) y VHL de tipo 2B (VHL con feocromocitomas y RCC).[11] En 2001, también se notificó la enfermedad de VHL de tipo 2C (con feocromocitomas aislados, pero sin hemangioblastomas ni RCC).[12] Los siguientes tipos de variantes patogénicas pueden producir manifestaciones clínicas de la enfermedad de VHL: variantes de cambio de sentido (de aminoácido), variantes sin sentido (terminadora), variantes con cambio en el marco de lectura, inserciones, deleciones parciales o completas y variantes del sitio de empalme. Estas, a su vez, se pueden dividir en variantes truncadoras (interruptoras) y variantes no truncadoras.
En los últimos años, ha habido excepciones a estas clasificaciones de la enfermedad de VHL, lo que indica que se justifica la detección en todas las personas con VHL.[10] Dada la importante superposición entre los fenotipos de VHL, las indicaciones actuales para la vigilancia no incorporan el genotipo de la persona o el subtipo clínico de VHL en las recomendaciones para la detección.
Variantes patogénicas de novo y mosaicismo
En algunos casos, una persona recibe un diagnóstico de enfermedad de VHL, incluso cuando no tiene familiares con esta enfermedad. Esta circunstancia se da cuando una persona afectada tiene una variante patogénica de novo (nueva) en el gen VHL. Los pacientes con diagnóstico de enfermedad de VHL, pero sin historia familiar de esta enfermedad, representan cerca del 23 % de los grupos familiares con enfermedad de VHL.[13] Una variante nueva es, por definición, un evento poscigótico porque no se transmitió de un progenitor.
Dependiendo del estadio de la embriogénesis en la que surge la variante nueva, es posible que aparezcan diferentes linajes de células somáticas portadoras de la variante. Esto influye en el grado de mosaicismo que se observa en los linajes celulares. El mosaicismo se produce cuando dos o más líneas celulares en una persona difieren en su genotipo. Estas líneas celulares diferentes provienen del mismo cigoto.[14] Si la variante de novo poscigótica afecta la línea celular gonadal, hay riesgo de transmitir una variante germinal a la descendencia.[13]
Trastornos alélicos
La policitemia asociada al gen VHL (también conocida como eritrocitosis familiar de tipo 2 o policitemia de Chuvash) es un trastorno sanguíneo autosómico recesivo raro causado por variantes patogénicas homocigóticas o heterocigóticas compuestas del gen VHL en el que las personas afectadas presentan un número anormalmente alto de eritrocitos (policitemia). Las personas con esta afección tienen variantes patogénicas bialélicas del gen VHL. En un principio, se creía que los tumores sindrómicos típicos de la enfermedad de VHL no se presentaban en estas personas afectadas.[15,16,17]
Otras alteraciones genéticas
En el RCC esporádico, la inactivación del gen VHL debida a mutación es el acontecimiento molecular más frecuente. Además de la inactivación de VHL, los tumores del carcinoma renal de células claras (ccRCC) esporádico a menudo albergan variantes de otros genes, como PBRM1, SETD2 y BAP1.[18,19] En el ccRCC esporádico, la inactivación de PBRM1, SETD2 y BAP1 causada por mutaciones en estos genes se consideran lesiones secundarias («segundos golpes») que se presentan después de las alteraciones en el gen VHL. Estos eventos contribuyen al desarrollo y crecimiento del ccRCC.[20,19] Es posible que las variantes patogénicas germinales en los genes PBRM1 y BAP1 produzcan formas hereditarias de ccRCC.[21] Se está investigando la función de los genes PBRM1, BAP1 y SETD2 en el desarrollo y la progresión del ccRCC relacionado con la enfermedad de VHL.
Referencias:
- Latif F, Tory K, Gnarra J, et al.: Identification of the von Hippel-Lindau disease tumor suppressor gene. Science 260 (5112): 1317-20, 1993.
- Knudson AG, Strong LC: Mutation and cancer: neuroblastoma and pheochromocytoma. Am J Hum Genet 24 (5): 514-32, 1972.
- Knudson AG: Genetics of human cancer. Annu Rev Genet 20: 231-51, 1986.
- Maher ER, Iselius L, Yates JR, et al.: Von Hippel-Lindau disease: a genetic study. J Med Genet 28 (7): 443-7, 1991.
- Binderup ML, Galanakis M, Budtz-Jørgensen E, et al.: Prevalence, birth incidence, and penetrance of von Hippel-Lindau disease (vHL) in Denmark. Eur J Hum Genet 25 (3): 301-307, 2017.
- Evans DG, Howard E, Giblin C, et al.: Birth incidence and prevalence of tumor-prone syndromes: estimates from a UK family genetic register service. Am J Med Genet A 152A (2): 327-32, 2010.
- Neumann HP, Wiestler OD: Clustering of features of von Hippel-Lindau syndrome: evidence for a complex genetic locus. Lancet 337 (8749): 1052-4, 1991.
- Poulsen ML, Budtz-Jørgensen E, Bisgaard ML: Surveillance in von Hippel-Lindau disease (vHL). Clin Genet 77 (1): 49-59, 2010.
- Reich M, Jaegle S, Neumann-Haefelin E, et al.: Genotype-phenotype correlation in von Hippel-Lindau disease. Acta Ophthalmol 99 (8): e1492-e1500, 2021.
- Salama Y, Albanyan S, Szybowska M, et al.: Comprehensive characterization of a Canadian cohort of von Hippel-Lindau disease patients. Clin Genet 96 (5): 461-467, 2019.
- Brauch H, Kishida T, Glavac D, et al.: Von Hippel-Lindau (VHL) disease with pheochromocytoma in the Black Forest region of Germany: evidence for a founder effect. Hum Genet 95 (5): 551-6, 1995.
- Hoffman MA, Ohh M, Yang H, et al.: von Hippel-Lindau protein mutants linked to type 2C VHL disease preserve the ability to downregulate HIF. Hum Mol Genet 10 (10): 1019-27, 2001.
- Sgambati MT, Stolle C, Choyke PL, et al.: Mosaicism in von Hippel-Lindau disease: lessons from kindreds with germline mutations identified in offspring with mosaic parents. Am J Hum Genet 66 (1): 84-91, 2000.
- Austin KD, Hall JG: Nontraditional inheritance. Pediatr Clin North Am 39 (2): 335-48, 1992.
- Ang SO, Chen H, Hirota K, et al.: Disruption of oxygen homeostasis underlies congenital Chuvash polycythemia. Nat Genet 32 (4): 614-21, 2002.
- Pastore YD, Jelinek J, Ang S, et al.: Mutations in the VHL gene in sporadic apparently congenital polycythemia. Blood 101 (4): 1591-5, 2003.
- Cario H, Schwarz K, Jorch N, et al.: Mutations in the von Hippel-Lindau (VHL) tumor suppressor gene and VHL-haplotype analysis in patients with presumable congenital erythrocytosis. Haematologica 90 (1): 19-24, 2005.
- Popova T, Hebert L, Jacquemin V, et al.: Germline BAP1 mutations predispose to renal cell carcinomas. Am J Hum Genet 92 (6): 974-80, 2013.
- Farley MN, Schmidt LS, Mester JL, et al.: A novel germline mutation in BAP1 predisposes to familial clear-cell renal cell carcinoma. Mol Cancer Res 11 (9): 1061-71, 2013.
- Cancer Genome Atlas Research Network: Comprehensive molecular characterization of clear cell renal cell carcinoma. Nature 499 (7456): 43-9, 2013.
- Benusiglio PR, Couvé S, Gilbert-Dussardier B, et al.: A germline mutation in PBRM1 predisposes to renal cell carcinoma. J Med Genet 52 (6): 426-30, 2015.
Aspectos de la biología molecular
El gen supresor de tumores VHL codifica 2 proteínas: una proteína de 213 aminoácidos (pVHL30) y una proteína de 154 aminoácidos; esta última se produce a partir de traducción interna.[1] La función más conocida de pVHL es la regulación de la actividad del factor inducible por hipoxia (HIF), que se vincula con supresión tumoral. Otras funciones notificadas de pVHL son la regulación de la formación de matriz extracelular, la maduración de los microtúbulos y del centrosoma, y la inactivación de p53.[2,3,4,5] Estas funciones se describen mejor en los párrafos que siguen.
Factores inducibles por hipoxia 1-α y 2-α
La pVHL regula las concentraciones celulares de las proteínas HIF1-α y HIF2-α actuando como un sitio de reconocimiento del sustrato HIF, una parte del complejo de la ubiquitina–ligasa E3.[5] En condiciones normóxicas, HIF1-α y HIF2-α sufren hidroxilación enzimática mediada por las prolil–hidroxilasas intracelulares. Las subunidades de HIF hidroxiladas se adhieren al complejo proteico VHL, que está unido mediante enlace covalente a la ubiquitina, y son degradadas por el proteasoma S26.[6,7]
La hipoxia inactiva las prolil–hidroxilasas, lo que conduce a la falta de hidroxilación de HIF. Las HIF1-α y HIF2-α no hidroxiladas no se unen al complejo proteico VHL para la ubiquitinación y, por lo tanto, se acumulan. Las concentraciones constitutivamente altas resultantes de HIF1-α y HIF2-α aumentan la transcripción de una variedad de genes, entre ellos genes de factores de crecimiento y angiogénicos, enzimas del metabolismo intermediario y genes que promueven fenotipos celulares con características de pluripotencialidad (stemness).[8]
Los HIF1-α y HIF2-α exhiben características funcionales diferentes que contrastan de manera parcial. En el contexto del carcinoma de células renales (RCC), se observa que el gen EPAS1, también conocido como HIF2A, actúa como oncogén, mientras que el gen HIF1A actúa como gen supresor de tumores. Al parecer HIF2-α aumenta de manera preferencial la actividad de Myc, mientras que HIF1-α inhibe la actividad de Myc.[9] Se observó que el factor relacionado con la hipoxia aumenta la transactivación de HIF2-α [10] y la inestabilidad de HIF1-α.[11] La pérdida preferencial del cromosoma 14q, el locus del gen HIF1A, disminuye las concentraciones de la proteína HIF1-α.[12]
En varios estudios con modelos de animales transgénicos o con xenoinjertos se observó que la inactivación de HIF2-α por parte de pVHL es necesaria y suficiente para la actividad de supresión de tumores de las proteínas pVHL. En la actualidad, HIF2-α se ha consolidado como una diana terapéutica para las neoplasias malignas asociadas a la enfermedad de Von Hippel-Lindau (VHL).[13,14,15] Se están probando inhibidores específicos de HIF2-α en ensayos preclínicos y clínicos.[16,17,18]
Regulación de microtúbulos y control de cilios del centrosoma
Los datos emergentes apuntan a la importancia del control mediado por pVHL del cilio primario y el ciclo ciliar del centrosoma. El cilio primario inmóvil actúa como un mecanosensor, regula la señalización celular y controla el comienzo de la mitosis celular.[19] La pérdida de la función del cilio primario conlleva pérdida de la capacidad de la célula de mantener la polaridad celular planar, lo que eventualmente produce formación de quistes.[20] La pérdida de pVHL conlleva la pérdida del cilio primario.[21] La pVHL se une a los microtúbulos y los estabiliza [22] por un mecanismo dependiente de la glucógeno–sintetasa 3.[23] La pérdida de la pVHL, o la expresión de una variante de pVHL en las células, también conlleva inestabilidad de los microtúbulos astrales, desregulación del punto de control de ensamblaje del huso mitótico y aumento de la aneuploidia.[4]
Control del ciclo celular
En líneas celulares con inactivación de VHL, se observó que después de la privación de pVHL la reintroducción de pVHL detiene el ciclo celular y aumenta la expresión de p27.[2] Además, pVHL desestabiliza la Skp2, y aumenta la p27 en respuesta al daño en el DNA.[24] La ubicación nuclear y la intensidad de p27 son inversamente proporcionales al grado tumoral.[25] La pVHL se une [26] a p53 y facilita su fosforilación de manera dependiente de la ATM.[27]
Control de la matriz extracelular
Se necesita pVHL funcional para el ensamblaje adecuado de la matriz de fibronectina extracelular.[28] Además, la fosforilación de pVHL regula la unión de la fibronectina y la secreción en el espacio extracelular.[29]
Regulación de la autofagia oncogénica
En el carcinoma renal de células claras (ccRCC), la actividad del receptor de potencial transitorio de melastatina 3 (TRPM3) estimula, mediante múltiples mecanismos complementarios, la autofagia oncogénica dependiente de las proteínas 1 asociadas a microtúbulos, de cadena ligera, 3 α y β (LC3A y LC3B). La supresión tumoral de VHL se presenta por inhibición de esta autofagia oncogénica de manera coordinada a través de la actividad de miR-204, que se expresa a partir del intrón 6 del gen codificador de TRPM3. La TRPM3 representa una diana aprovechable para el tratamiento del ccRCC.[30,31]
Modelos animales de la enfermedad de Von Hippel-Lindau
Los ratones con inactivación de Vhl mueren dentro del útero. Los ratones heterocigóticos para Vhl presentan lesiones vasculares en el hígado similares a hemangioblastomas.[32] La inactivación condicional específica del gen Vhl en el riñón de ratón produce quistes similares a los de la enfermedad de VHL, pero no origina RCC. La inactivación coordinada de Vhl y Pten conlleva una tasa más alta de formación de quistes, pero no se observa RCC evidente.[33] Los homólogos murinos de la variante patogénica VHL R200W produjeron policitemia en ratones, una fenocopia de la policitemia de Chuvash.[34] El descubrimiento de posibles nuevos genes supresores de tumores que están inactivados en el contexto del RCC, como PBRM1,[35]SETD2,[36] y BAP1,[37] ofrecen nuevas vías para el desarrollo de modelos animales relevantes de al menos algunas de las manifestaciones de la enfermedad de VHL.
Referencias:
- Iliopoulos O, Ohh M, Kaelin WG: pVHL19 is a biologically active product of the von Hippel-Lindau gene arising from internal translation initiation. Proc Natl Acad Sci U S A 95 (20): 11661-6, 1998.
- Pause A, Lee S, Lonergan KM, et al.: The von Hippel-Lindau tumor suppressor gene is required for cell cycle exit upon serum withdrawal. Proc Natl Acad Sci U S A 95 (3): 993-8, 1998.
- Kurban G, Hudon V, Duplan E, et al.: Characterization of a von Hippel Lindau pathway involved in extracellular matrix remodeling, cell invasion, and angiogenesis. Cancer Res 66 (3): 1313-9, 2006.
- Thoma CR, Toso A, Gutbrodt KL, et al.: VHL loss causes spindle misorientation and chromosome instability. Nat Cell Biol 11 (8): 994-1001, 2009.
- Maxwell PH, Wiesener MS, Chang GW, et al.: The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature 399 (6733): 271-5, 1999.
- Ivan M, Kondo K, Yang H, et al.: HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing. Science 292 (5516): 464-8, 2001.
- Jaakkola P, Mole DR, Tian YM, et al.: Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science 292 (5516): 468-72, 2001.
- Keith B, Johnson RS, Simon MC: HIF1α and HIF2α: sibling rivalry in hypoxic tumour growth and progression. Nat Rev Cancer 12 (1): 9-22, 2012.
- Gordan JD, Bertout JA, Hu CJ, et al.: HIF-2alpha promotes hypoxic cell proliferation by enhancing c-myc transcriptional activity. Cancer Cell 11 (4): 335-47, 2007.
- Koh MY, Lemos R, Liu X, et al.: The hypoxia-associated factor switches cells from HIF-1α- to HIF-2α-dependent signaling promoting stem cell characteristics, aggressive tumor growth and invasion. Cancer Res 71 (11): 4015-27, 2011.
- Koh MY, Darnay BG, Powis G: Hypoxia-associated factor, a novel E3-ubiquitin ligase, binds and ubiquitinates hypoxia-inducible factor 1alpha, leading to its oxygen-independent degradation. Mol Cell Biol 28 (23): 7081-95, 2008.
- Monzon FA, Alvarez K, Peterson L, et al.: Chromosome 14q loss defines a molecular subtype of clear-cell renal cell carcinoma associated with poor prognosis. Mod Pathol 24 (11): 1470-9, 2011.
- Kondo K, Klco J, Nakamura E, et al.: Inhibition of HIF is necessary for tumor suppression by the von Hippel-Lindau protein. Cancer Cell 1 (3): 237-46, 2002.
- Kondo K, Kim WY, Lechpammer M, et al.: Inhibition of HIF2alpha is sufficient to suppress pVHL-defective tumor growth. PLoS Biol 1 (3): E83, 2003.
- Zimmer M, Doucette D, Siddiqui N, et al.: Inhibition of hypoxia-inducible factor is sufficient for growth suppression of VHL-/- tumors. Mol Cancer Res 2 (2): 89-95, 2004.
- Zimmer M, Ebert BL, Neil C, et al.: Small-molecule inhibitors of HIF-2a translation link its 5'UTR iron-responsive element to oxygen sensing. Mol Cell 32 (6): 838-48, 2008.
- Metelo AM, Noonan HR, Li X, et al.: Pharmacological HIF2α inhibition improves VHL disease-associated phenotypes in zebrafish model. J Clin Invest 125 (5): 1987-97, 2015.
- Scheuermann TH, Li Q, Ma HW, et al.: Allosteric inhibition of hypoxia inducible factor-2 with small molecules. Nat Chem Biol 9 (4): 271-6, 2013.
- Pan J, Snell W: The primary cilium: keeper of the key to cell division. Cell 129 (7): 1255-7, 2007.
- Simons M, Walz G: Polycystic kidney disease: cell division without a c(l)ue? Kidney Int 70 (5): 854-64, 2006.
- Thoma CR, Frew IJ, Hoerner CR, et al.: pVHL and GSK3beta are components of a primary cilium-maintenance signalling network. Nat Cell Biol 9 (5): 588-95, 2007.
- Hergovich A, Lisztwan J, Barry R, et al.: Regulation of microtubule stability by the von Hippel-Lindau tumour suppressor protein pVHL. Nat Cell Biol 5 (1): 64-70, 2003.
- Hergovich A, Lisztwan J, Thoma CR, et al.: Priming-dependent phosphorylation and regulation of the tumor suppressor pVHL by glycogen synthase kinase 3. Mol Cell Biol 26 (15): 5784-96, 2006.
- Roe JS, Kim HR, Hwang IY, et al.: von Hippel-Lindau protein promotes Skp2 destabilization on DNA damage. Oncogene 30 (28): 3127-38, 2011.
- Kim J, Jonasch E, Alexander A, et al.: Cytoplasmic sequestration of p27 via AKT phosphorylation in renal cell carcinoma. Clin Cancer Res 15 (1): 81-90, 2009.
- Roe JS, Youn HD: The positive regulation of p53 by the tumor suppressor VHL. Cell Cycle 5 (18): 2054-6, 2006.
- Roe JS, Kim H, Lee SM, et al.: p53 stabilization and transactivation by a von Hippel-Lindau protein. Mol Cell 22 (3): 395-405, 2006.
- Ohh M, Yauch RL, Lonergan KM, et al.: The von Hippel-Lindau tumor suppressor protein is required for proper assembly of an extracellular fibronectin matrix. Mol Cell 1 (7): 959-68, 1998.
- Lolkema MP, Gervais ML, Snijckers CM, et al.: Tumor suppression by the von Hippel-Lindau protein requires phosphorylation of the acidic domain. J Biol Chem 280 (23): 22205-11, 2005.
- Hall DP, Cost NG, Hegde S, et al.: TRPM3 and miR-204 establish a regulatory circuit that controls oncogenic autophagy in clear cell renal cell carcinoma. Cancer Cell 26 (5): 738-53, 2014.
- Mikhaylova O, Stratton Y, Hall D, et al.: VHL-regulated MiR-204 suppresses tumor growth through inhibition of LC3B-mediated autophagy in renal clear cell carcinoma. Cancer Cell 21 (4): 532-46, 2012.
- Haase VH, Glickman JN, Socolovsky M, et al.: Vascular tumors in livers with targeted inactivation of the von Hippel-Lindau tumor suppressor. Proc Natl Acad Sci U S A 98 (4): 1583-8, 2001.
- Frew IJ, Thoma CR, Georgiev S, et al.: pVHL and PTEN tumour suppressor proteins cooperatively suppress kidney cyst formation. EMBO J 27 (12): 1747-57, 2008.
- Hickey MM, Lam JC, Bezman NA, et al.: von Hippel-Lindau mutation in mice recapitulates Chuvash polycythemia via hypoxia-inducible factor-2alpha signaling and splenic erythropoiesis. J Clin Invest 117 (12): 3879-89, 2007.
- Varela I, Tarpey P, Raine K, et al.: Exome sequencing identifies frequent mutation of the SWI/SNF complex gene PBRM1 in renal carcinoma. Nature 469 (7331): 539-42, 2011.
- Dalgliesh GL, Furge K, Greenman C, et al.: Systematic sequencing of renal carcinoma reveals inactivation of histone modifying genes. Nature 463 (7279): 360-3, 2010.
- Peña-Llopis S, Vega-Rubín-de-Celis S, Liao A, et al.: BAP1 loss defines a new class of renal cell carcinoma. Nat Genet 44 (7): 751-9, 2012.
Manifestaciones clínicas
Intervalos de edad y riesgo acumulado de diferentes neoplasias asociadas a la enfermedad
La edad de inicio de la enfermedad de Von Hippel-Lindau (VHL) varía entre familias y miembros de la misma familia. En este hecho se basan las directrices sobre la edad de inicio y la frecuencia de los exámenes de vigilancia presintomática. De todas las manifestaciones de la enfermedad de VHL, los hemangioblastomas de retina y los feocromocitomas son los que se presentan a una edad más temprana; por lo tanto, se recomienda la detección en niños menores de 10 años. Por lo menos en un estudio se demostró que la incidencia de las lesiones nuevas varía según la edad del paciente, la variante patogénica subyacente y el órgano afectado.[1] En el Cuadro 1 se enumeran ejemplos de la media de edad y el intervalo de edad para las manifestaciones clínicas de la enfermedad de VHL.
| Neoplasia | Media de edad (intervalo) en años | Riesgo acumulado (%) |
|---|---|---|
| PHEO = feocromocitoma | ||
| a Adaptado de Choyke et al[2]y Lonser et al.[3] | ||
| b Se dispone de datos limitados sobre los cistoadenomas de ligamento ancho, ligamento redondo y epidídimo. | ||
| Carcinoma de células renales | 37 (16–67) | 24–45 |
| Feocromocitoma | 30 (5–58) | 10–20 |
| Tumor o quiste de páncreas | 36 (5–70) | 35–70 |
| Hemangioblastoma de retina | 25 (1–67) | 25–60 |
| Hemangioblastoma de cerebelo | 33 (9–78) | 44–72 |
| Hemangioblastoma de tronco encefálico | 32 (12–46) | 10–25 |
| Hemangioblastoma de médula espinal | 33 (12–66) | 13–50 |
| Tumor de saco endolinfático | 22 (12–50) | 10 |
Para obtener más información, consultar la sección Diagnóstico clínico de la enfermedad de Von Hippel-Lindau.
Referencias:
- Binderup ML, Budtz-Jørgensen E, Bisgaard ML: Risk of new tumors in von Hippel-Lindau patients depends on age and genotype. Genet Med 18 (1): 89-97, 2016.
- Choyke PL, Glenn GM, Walther MM, et al.: von Hippel-Lindau disease: genetic, clinical, and imaging features. Radiology 194 (3): 629-42, 1995.
- Lonser RR, Glenn GM, Walther M, et al.: von Hippel-Lindau disease. Lancet 361 (9374): 2059-67, 2003.
Manifestaciones tisulares
Manifestaciones renales
Más del 55 % de las personas con la enfermedad de Von Hippel-Lindau (VHL) solo presentan múltiples quistes de células renales. Los carcinomas de células renales (RCC) relacionados con la enfermedad de VHL suelen ser multifocales y bilaterales, y forman masas con componentes quísticos y sólidos.[1] En la enfermedad de VHL, se notificó un riesgo acumulado de RCC del 24 % al 45 %. Los RCC menores de 3 cm tienden a ser de grado bajo (grado nuclear de Fuhrman 2) y de invasión mínima.[2] Sin embargo, su tasa de crecimiento varía mucho.[3] En una investigación de 228 lesiones renales en 28 pacientes seguidos durante por lo menos 1 año, se observó que la transición de un quiste simple a una lesión sólida fue infrecuente.[1] Los quistes complejos y las lesiones sólidas contenían tejido neoplásico uniformemente extendido. Estos datos se pueden usar para predecir la progresión de las lesiones renales (de benignas a malignas) en pacientes con enfermedad de VHL. En la Figura 1 se observan tumores renales bilaterales en un paciente con enfermedad de VHL.
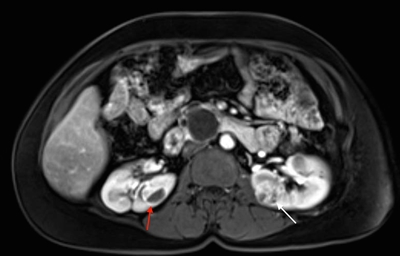
Es posible que los tumores de más de 3 cm aumenten de grado a medida que crecen y que produzcan metástasis.[3,4] Los RCC a menudo permanecen asintomáticos durante largos períodos de tiempo.
Hemangioblastomas de retina
Las manifestaciones retinianas, que se notificaron por primera vez hace más de un siglo, fueron una de las primeras características reconocidas de la enfermedad de VHL. Los hemangioblastomas de retina (que también se llaman angiomas capilares retinianos) son una de las manifestaciones más comunes de la enfermedad de VHL y se presentan en más del 50 % de los pacientes.[5] El compromiso retiniano es una de las manifestaciones más tempranas de la enfermedad de VHL, con una media de edad de inicio a los 25 años.[6,7] Estos tumores son la primera manifestación de la enfermedad de VHL en casi el 80 % de las personas afectadas y a veces surgen en niños de tan solo 1 año.[7,8,9] Los hemangioblastomas de retina esporádicos son raros; en un estudio de registro se notificó que el 84 % de estos tumores se relacionaron con la enfermedad de VHL.[10]
Los hemangioblastomas retinianos surgen más a menudo en la periferia de la retina. También se pueden presentar en otros lugares como el nervio óptico, un área más difícil de tratar. Estos hemangioblastomas son tumores esféricos de color naranja brillante que tienen un suministro vascular tortuoso. Casi el 50 % de los pacientes tienen hemangioblastomas de retina bilaterales.[5] La mediana del número de lesiones por ojo afectado es de 6.[11] Los pacientes con enfermedad de VHL también pueden presentar otras lesiones retinianas, como hamartomas vasculares de retina y tumores vasculares planos ubicados en la superficie de la retina.[12]
Los estudios longitudinales ayudan a explicar la historia natural de estos tumores. Si no se tratan, los hemangioblastomas de retina a veces son una fuente importante de morbilidad en los pacientes con enfermedad de VHL. Cerca del 8 % de los pacientes [5] desarrollará ceguera causada por varios mecanismos como maculopatía secundaria; lo que a veces contribuye a desprendimiento de retina o directamente causa neurodegeneración de la misma.[13] En un estudio se indicó que la gravedad de la alteración visual (incluso la necesidad de enucleación y la aparición de tisis bulbar) tal vez dependan del genotipo de la enfermedad de VHL del paciente.[14] Los pacientes con lesiones retinianas sintomáticas a menudo tienen muchos hemangioblastomas de retina grandes. Los estudios de seguimiento a largo plazo demuestran que la mayoría de las lesiones de la retina crecen de forma lenta y que no suelen presentarse lesiones nuevas.[11,15]
Hemangioblastomas de cerebelo y médula espinal
Los hemangioblastomas son la manifestación más común en los pacientes con enfermedad de VHL y afectan a más del 70 % de las personas. En un estudio prospectivo se evaluó la evolución natural del los hemangioblastomas.[16] La media de edad de aparición de los hemangioblastomas del sistema nervioso central (SNC) es de 29,1 años (intervalo, 7–73 años).[17] Los hemangioblastomas del SNC se observaron con mayor frecuencia en el cerebelo (45 %), la médula espinal (36 %), la cola de caballo (11 %) y el tronco encefálico (7 %).[18] Aunque los hemangioblastomas esporádicos son casi siempre solitarios por naturaleza, las lesiones en el SNC asociadas a la enfermedad de VHL a menudo son multifocales. Luego de una media de seguimiento de 7 años, el 72 % de 225 pacientes estudiados presentaron lesiones nuevas.[18] En las figuras 2 y 3 se muestran hemangioblastomas de cerebelo y médula espinal, respectivamente, en pacientes con enfermedad de VHL.
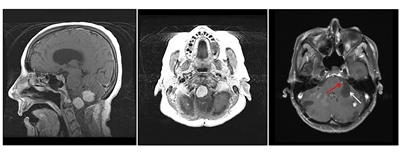
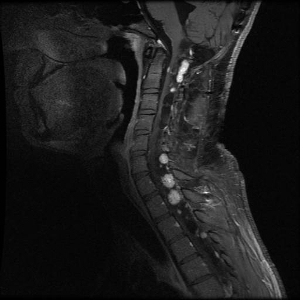
Feocromocitomas y paragangliomas
La tasa de formación de feocromocitomas en la población de pacientes con enfermedad de VHL es del 25 % al 30 %.[19,20] De los pacientes con feocromocitomas asociados a la enfermedad de VHL, el 44 % presentó enfermedad en ambas glándulas suprarrenales.[21] La tasa de transformación maligna es muy baja. Por lo general, las concentraciones de normetanefrina en plasma y orina son elevadas en los pacientes con enfermedad de VHL,[22] y cerca de dos tercios presentarán manifestaciones físicas como hipertensión, taquicardia y palpitaciones.[19] Los pacientes con una pérdida parcial de la función del gen VHL (enfermedad de tipo 2) exhiben un riesgo más alto de feocromocitomas que los pacientes que pierden por completo la función del gen VHL (enfermedad de tipo 1); estos últimos casi nunca presentan feocromocitomas.[19,23,24,25] En una cohorte de 182 pacientes con feocromocitomas y paragangliomas no vinculados con un diagnóstico de enfermedad de VHL, solo se encontró una variante patogénica germinal de VHL en 1 paciente.[26]
Los paragangliomas son raros en los pacientes con enfermedad de VHL, pero a veces se presentan en la cabeza, el cuello o el abdomen.[27] En una revisión de pacientes con enfermedad de VHL que presentaron feocromocitomas o paragangliomas, se descubrió que como manifestación inicial el 90 % de los pacientes presentó feocromocitomas y solo el 19 % presentó un paraganglioma.[21]
La media de edad en el momento del diagnóstico de los feocromocitomas y paragangliomas relacionados con la enfermedad de VHL es de alrededor de 30 años.[20,28] En una serie, el diagnóstico en los pacientes con múltiples tumores se estableció casi 10 años más temprano que en los pacientes con lesiones solitarias (19 vs. 34 años; P < 0,001).[28] En una cohorte, el feocromocitoma se diagnosticó en pacientes tan jóvenes como 5 años,[20] lo que justifica la obtención de pruebas tempranas. Los 21 pacientes pediátricos de una cohorte de 273 pacientes con feocromocitomas, tenían concentraciones plasmáticas elevadas de normetanefrinas.[20]
Manifestaciones pancreáticas
Los pacientes con enfermedad de VHL a veces presentan múltiples cistoadenomas serosos, tumores neuroendocrinos de páncreas y quistes pancreáticos simples.[6,7] En un estudio se notificó que el 15 % de los pacientes con enfermedad de VHL presentan tumores neuroendocrinos de páncreas.[29] Los pacientes con enfermedad de VHL no tienen un aumento del riesgo de adenocarcinoma de páncreas. Los cistoadenomas serosos son tumores benignos que no exigen intervención. Los pacientes con enfermedad de VHL a veces presentan muchos quistes pancreáticos, pero es muy infrecuente que estos quistes causen obstrucción biliar sintomática. Casi siempre se mantiene el funcionamiento endocrino; sin embargo, los pacientes con enfermedad quística extensa tal vez necesiten cirugía pancreática y administración de suplementos pancreáticos exocrinos.
Los quistes y los cistoadenomas de páncreas no son malignos, pero los tumores neuroendocrinos de páncreas exhiben características de malignidad.[30] Los tumores neuroendocrinos de páncreas por lo general no son funcionantes, pero a veces metastatizan a los ganglios linfáticos y al hígado. El riesgo de metástasis de los tumores neuroendocrinos de páncreas se analizó en una cohorte grande de pacientes, donde se encontró una media de edad de diagnóstico de 38 años (intervalo, 16–68 años).[31] El riesgo de metástasis fue más bajo en los pacientes con lesiones primarias pequeñas (≤3 cm), en los pacientes sin una variante patogénica del exón 3 y en aquellos cuyo tumor tuvo un tiempo de duplicación lento (>500 días). Es posible vigilar la evolución de los tumores neuroendocrinos de páncreas no funcionantes mediante imágenes, y se indica una intervención cuando los tumores alcanzan un tamaño de 3 cm. Se puede considerar la cirugía para las lesiones en la cabeza del páncreas de un tamaño más pequeño con el fin de limitar la complejidad operatoria.
Tumores de saco endolinfático
Los tumores de saco endolinfático son tumores adenomatosos del conducto endolinfático o del saco endolinfático en la parte posterior del peñasco.[32] Los tumores de saco endolinfático esporádicos son raros, pero se observan en imágenes en el 11 % al 16 % de los pacientes con enfermedad de VHL. Aunque estos tumores no producen metástasis, son invasores a nivel local, y erosionan el peñasco y las estructuras del oído interno.[32,33] Cerca del 30 % de los pacientes con enfermedad de VHL y tumores de saco endolinfático exhiben lesiones bilaterales.[32,34]
Los tumores de saco endolinfático son una causa importante de morbilidad en pacientes con enfermedad de VHL. Los tumores de saco endolinfático evidentes en las imágenes producen muchos síntomas, entre ellos, hipoacusia (95 % de los pacientes); acúfenos (92 %); síntomas vestibulares, como vértigo y desequilibrio (62 %); plenitud auditiva (29 %) y paresia facial (8 %).[32,33] En cerca de la mitad de los pacientes, los síntomas (en especial, la hipoacusia) aparece de manera súbita, posiblemente por una hemorragia aguda dentro del laberinto.[33] La hipoacusia y la disfunción vestibular en los pacientes con enfermedad de VHL también pueden aparecer en ausencia de indicios radiológicos de tumores de saco endolinfático (alrededor del 60 % de todos los pacientes sintomáticos), se piensa que esto se debe a tumores microscópicos en el saco endolinfático.[32]
La hipoacusia vinculada a los tumores de saco endolinfático suele ser irreversible. Las imágenes seriadas para la detección temprana de los tumores de saco endolinfático en pacientes asintomáticos y la resección de lesiones evidentes en las imágenes radiológicas son componentes importantes de la atención de pacientes con enfermedad de VHL.[35,36] La resección quirúrgica por petrosectomía posterior retrolaberíntica suele ser curativa y puede prevenir la aparición o empeoramiento de la hipoacusia; este procedimiento también puede mejorar los síntomas vestibulares.[33,35]
Cistoadenomas papilares de ligamento ancho o de ligamento redondo del útero
A veces aparecen tumores en el ligamento ancho del útero en mujeres con enfermedad de VHL, estos se conocen como cistoadenomas papilares. Estos tumores son muy raros, se han notificado menos de 20 casos en la bibliografía.[37] Los cistoadenomas papilares son idénticos, desde el punto de vista histológico, a los cistoadenomas de epidídimo, que se observan con frecuencia en los varones con enfermedad de VHL.[38] Una diferencia importante es que los cistoadenomas papilares se observan casi exclusivamente en pacientes con enfermedad de VHL, mientras que los cistoadenomas de epidídimo se presentan de manera esporádica.[39] Estos tumores a menudo son quísticos, y aunque a veces son grandes, por lo general tienen un comportamiento de crecimiento lento o escasa malignidad.
Cistoadenomas de epidídimo
Los quistes de epidídimo llenos de líquido, o espermatoceles, son muy comunes en los hombres adultos. En los pacientes con enfermedad de VHL, a veces se forman neoplasias quísticas más complejas en el epidídimo conocidas como cistoadenomas papilares, que son raros en la población general. Mas de un tercio de todos los casos de cistoadenomas de epidídimo notificados en la bibliografía médica, y la mayoría de lo casos de cistoadenomas bilaterales corresponden a pacientes con enfermedad de VHL.[40] Estas lesiones bien circunscritas contienen cantidades variables de componentes quísticos y papilares recubiertos por células claras epiteliales cúbicas o cilíndricas.[41] En los pacientes sintomáticos, la presentación más común del cistoadenoma de epidídimo es una masa escrotal indolora de crecimiento lento. El diagnóstico diferencial de los tumores de epidídimo abarca el tumor adenomatoide (tumor más común en este sitio), el ccRCC metastásico y el mesotelioma papilar.[42]
En una serie pequeña, el análisis histológico no reveló características que suelen asociarse con una neoplasia maligna, como figuras mitóticas, pleomorfismo nuclear y necrosis. Las lesiones exhibieron una positividad fuerte para CK7 y negatividad para RCC. Todos los tumores fueron positivos para la anhidrasa carbónica IX (CAIX). En la mayoría de los casos fueron positivos para PAX8. Estas características evocan el RCC papilar de células claras, una forma relativamente benigna de RCC sin potencial metastásico conocido.[38]
Referencias:
- Choyke PL, Glenn GM, Walther MM, et al.: The natural history of renal lesions in von Hippel-Lindau disease: a serial CT study in 28 patients. AJR Am J Roentgenol 159 (6): 1229-34, 1992.
- Poston CD, Jaffe GS, Lubensky IA, et al.: Characterization of the renal pathology of a familial form of renal cell carcinoma associated with von Hippel-Lindau disease: clinical and molecular genetic implications. J Urol 153 (1): 22-6, 1995.
- Walther MM, Choyke PL, Glenn G, et al.: Renal cancer in families with hereditary renal cancer: prospective analysis of a tumor size threshold for renal parenchymal sparing surgery. J Urol 161 (5): 1475-9, 1999.
- Walther MM, Lubensky IA, Venzon D, et al.: Prevalence of microscopic lesions in grossly normal renal parenchyma from patients with von Hippel-Lindau disease, sporadic renal cell carcinoma and no renal disease: clinical implications. J Urol 154 (6): 2010-4; discussion 2014-5, 1995.
- Chew EY: Ocular manifestations of von Hippel-Lindau disease: clinical and genetic investigations. Trans Am Ophthalmol Soc 103: 495-511, 2005.
- Choyke PL, Glenn GM, Walther MM, et al.: von Hippel-Lindau disease: genetic, clinical, and imaging features. Radiology 194 (3): 629-42, 1995.
- Lonser RR, Glenn GM, Walther M, et al.: von Hippel-Lindau disease. Lancet 361 (9374): 2059-67, 2003.
- Dollfus H, Massin P, Taupin P, et al.: Retinal hemangioblastoma in von Hippel-Lindau disease: a clinical and molecular study. Invest Ophthalmol Vis Sci 43 (9): 3067-74, 2002.
- Wong WT, Agrón E, Coleman HR, et al.: Clinical characterization of retinal capillary hemangioblastomas in a large population of patients with von Hippel-Lindau disease. Ophthalmology 115 (1): 181-8, 2008.
- Binderup MLM, Stendell AS, Galanakis M, et al.: Retinal hemangioblastoma: prevalence, incidence and frequency of underlying von Hippel-Lindau disease. Br J Ophthalmol 102 (7): 942-947, 2018.
- Kreusel KM, Bechrakis NE, Krause L, et al.: Retinal angiomatosis in von Hippel-Lindau disease: a longitudinal ophthalmologic study. Ophthalmology 113 (8): 1418-24, 2006.
- Schmidt D, Neumann HP: Retinal vascular hamartoma in von Hippel-Lindau disease. Arch Ophthalmol 113 (9): 1163-7, 1995.
- Wittström E, Nordling M, Andréasson S: Genotype-phenotype correlations, and retinal function and structure in von Hippel-Lindau disease. Ophthalmic Genet 35 (2): 91-106, 2014.
- Reich M, Jaegle S, Neumann-Haefelin E, et al.: Genotype-phenotype correlation in von Hippel-Lindau disease. Acta Ophthalmol 99 (8): e1492-e1500, 2021.
- Toy BC, Agrón E, Nigam D, et al.: Longitudinal analysis of retinal hemangioblastomatosis and visual function in ocular von Hippel-Lindau disease. Ophthalmology 119 (12): 2622-30, 2012.
- Huntoon K, Wu T, Elder JB, et al.: Biological and clinical impact of hemangioblastoma-associated peritumoral cysts in von Hippel-Lindau disease. J Neurosurg 124 (4): 971-6, 2016.
- Kanno H, Kuratsu J, Nishikawa R, et al.: Clinical features of patients bearing central nervous system hemangioblastoma in von Hippel-Lindau disease. Acta Neurochir (Wien) 155 (1): 1-7, 2013.
- Lonser RR, Butman JA, Huntoon K, et al.: Prospective natural history study of central nervous system hemangioblastomas in von Hippel-Lindau disease. J Neurosurg 120 (5): 1055-62, 2014.
- Walther MM, Reiter R, Keiser HR, et al.: Clinical and genetic characterization of pheochromocytoma in von Hippel-Lindau families: comparison with sporadic pheochromocytoma gives insight into natural history of pheochromocytoma. J Urol 162 (3 Pt 1): 659-64, 1999.
- Aufforth RD, Ramakant P, Sadowski SM, et al.: Pheochromocytoma Screening Initiation and Frequency in von Hippel-Lindau Syndrome. J Clin Endocrinol Metab 100 (12): 4498-504, 2015.
- Welander J, Söderkvist P, Gimm O: Genetics and clinical characteristics of hereditary pheochromocytomas and paragangliomas. Endocr Relat Cancer 18 (6): R253-76, 2011.
- Eisenhofer G, Walther MM, Huynh TT, et al.: Pheochromocytomas in von Hippel-Lindau syndrome and multiple endocrine neoplasia type 2 display distinct biochemical and clinical phenotypes. J Clin Endocrinol Metab 86 (5): 1999-2008, 2001.
- Zbar B, Kishida T, Chen F, et al.: Germline mutations in the Von Hippel-Lindau disease (VHL) gene in families from North America, Europe, and Japan. Hum Mutat 8 (4): 348-57, 1996.
- Chen F, Slife L, Kishida T, et al.: Genotype-phenotype correlation in von Hippel-Lindau disease: identification of a mutation associated with VHL type 2A. J Med Genet 33 (8): 716-7, 1996.
- Friedrich CA: Genotype-phenotype correlation in von Hippel-Lindau syndrome. Hum Mol Genet 10 (7): 763-7, 2001.
- Eisenhofer G, Vocke CD, Elkahloun A, et al.: Genetic screening for von Hippel-Lindau gene mutations in non-syndromic pheochromocytoma: low prevalence and false-positives or misdiagnosis indicate a need for caution. Horm Metab Res 44 (5): 343-8, 2012.
- Shuch B, Ricketts CJ, Metwalli AR, et al.: The genetic basis of pheochromocytoma and paraganglioma: implications for management. Urology 83 (6): 1225-32, 2014.
- Eisenhofer G, Timmers HJ, Lenders JW, et al.: Age at diagnosis of pheochromocytoma differs according to catecholamine phenotype and tumor location. J Clin Endocrinol Metab 96 (2): 375-84, 2011.
- Charlesworth M, Verbeke CS, Falk GA, et al.: Pancreatic lesions in von Hippel-Lindau disease? A systematic review and meta-synthesis of the literature. J Gastrointest Surg 16 (7): 1422-8, 2012.
- Libutti SK, Choyke PL, Bartlett DL, et al.: Pancreatic neuroendocrine tumors associated with von Hippel Lindau disease: diagnostic and management recommendations. Surgery 124 (6): 1153-9, 1998.
- Blansfield JA, Choyke L, Morita SY, et al.: Clinical, genetic and radiographic analysis of 108 patients with von Hippel-Lindau disease (VHL) manifested by pancreatic neuroendocrine neoplasms (PNETs). Surgery 142 (6): 814-8; discussion 818.e1-2, 2007.
- Manski TJ, Heffner DK, Glenn GM, et al.: Endolymphatic sac tumors. A source of morbid hearing loss in von Hippel-Lindau disease. JAMA 277 (18): 1461-6, 1997.
- Choo D, Shotland L, Mastroianni M, et al.: Endolymphatic sac tumors in von Hippel-Lindau disease. J Neurosurg 100 (3): 480-7, 2004.
- Megerian CA, Haynes DS, Poe DS, et al.: Hearing preservation surgery for small endolymphatic sac tumors in patients with von Hippel-Lindau syndrome. Otol Neurotol 23 (3): 378-87, 2002.
- Kim HJ, Butman JA, Brewer C, et al.: Tumors of the endolymphatic sac in patients with von Hippel-Lindau disease: implications for their natural history, diagnosis, and treatment. J Neurosurg 102 (3): 503-12, 2005.
- Lonser RR, Kim HJ, Butman JA, et al.: Tumors of the endolymphatic sac in von Hippel-Lindau disease. N Engl J Med 350 (24): 2481-6, 2004.
- Nogales FF, Goyenaga P, Preda O, et al.: An analysis of five clear cell papillary cystadenomas of mesosalpinx and broad ligament: four associated with von Hippel-Lindau disease and one aggressive sporadic type. Histopathology 60 (5): 748-57, 2012.
- Cox R, Vang R, Epstein JI: Papillary cystadenoma of the epididymis and broad ligament: morphologic and immunohistochemical overlap with clear cell papillary renal cell carcinoma. Am J Surg Pathol 38 (5): 713-8, 2014.
- Brady A, Nayar A, Cross P, et al.: A detailed immunohistochemical analysis of 2 cases of papillary cystadenoma of the broad ligament: an extremely rare neoplasm characteristic of patients with von hippel-lindau disease. Int J Gynecol Pathol 31 (2): 133-40, 2012.
- Odrzywolski KJ, Mukhopadhyay S: Papillary cystadenoma of the epididymis. Arch Pathol Lab Med 134 (4): 630-3, 2010.
- Uppuluri S, Bhatt S, Tang P, et al.: Clear cell papillary cystadenoma with sonographic and histopathologic correlation. J Ultrasound Med 25 (11): 1451-3, 2006.
- Vijayvargiya M, Jain D, Mathur SR, et al.: Papillary cystadenoma of the epididymis associated with von Hippel-Lindau disease diagnosed on fine needle aspiration cytology. Cytopathology 25 (4): 279-81, 2014.
Evaluación del riesgo genético para la enfermedad de Von Hippel-Lindau
El principal factor de riesgo de la enfermedad de VHL (o cualquier forma hereditaria de cáncer de riñón) es la presencia de un familiar afectado. Durante la evaluación del riesgo también se debe considerar el sexo y la edad de aparición de neoplasias específicas asociadas a la enfermedad de VHL. Por ejemplo, los feocromocitomas a veces aparecen temprano en la niñez,[1] incluso a los 8 años de edad.[2] Los hallazgos clínicos de la enfermedad de VHL específicos según el sexo incluyen cistoadenomas de epidídimo en varones (10–26 %), que son prácticamente patognomónicos de la enfermedad de VHL, en especial cuando se presentan de forma bilateral. Además, estas lesiones son infrecuentes en la población masculina general. Los quistes de epidídimo también son frecuentes en la enfermedad de VHL, pero se han notificado en el 23 % de la población general, lo que les resta valor para determinar el diagnóstico.[1] Las mujeres exhiben lesiones similares, desde el punto de vista histológico, a los cistoadenomas, que surgen en el ligamento ancho.
Cada descendiente (niño o niña) de una persona con enfermedad de VHL tiene una probabilidad del 50 % de heredar el alelo variante del gen VHL del progenitor afectado.
Diagnóstico clínico de la enfermedad de Von Hippel-Lindau
El diagnóstico de la enfermedad de VHL a menudo se basa en criterios clínicos. Si la historia familiar es compatible con la enfermedad de VHL, es posible establecer un diagnóstico clínico de VHL en un familiar que no se evaluó antes cuando esta persona presenta uno o más tumores específicos relacionados con la enfermedad de VHL (por ejemplo, hemangioblastoma del SNC o de retina, feocromocitomas, ccRCC o tumores de saco endolinfático). Si un paciente no tiene antecedentes familiares de enfermedad de VHL, debe cumplir con uno de los siguientes criterios: 1) dos o más hemangioblastomas del SNC, o 2) un hemangioblastoma del SNC y a) un tumor visceral o b) un tumor de saco endolinfático. Para obtener más información sobre los detalles del diagnóstico de la enfermedad de VHL, consulte el Cuadro 2.[3,4,5]
En 1998, se notificaron todas las variantes patogénicas germinales identificadas en una cohorte de 93 familias con enfermedad de VHL. Desde entonces, el diagnóstico de la enfermedad de VHL se basa en una combinación de lo siguiente: 1) manifestaciones clínicas relacionadas con la enfermedad de VHL y 2) pruebas genéticas para las variantes patogénicas de VHL identificadas en las familias. Esta estrategia diagnóstica puede ser diferente entre los miembros de una familia. En el Cuadro 2 se resume un abordaje combinado en el que se usan los dos métodos mencionados antes (es decir, la identificación de las manifestaciones clínicas de la enfermedad de VHL y las pruebas genéticas de VHL).
| Historia familiar compatible con la enfermedad de VHL | Pruebas genéticas | Escenarios para el diagnóstico clínico | Exigencias para el diagnóstico clínico |
|---|---|---|---|
| SNC = sistema nervioso central; ccRCC = carcinoma renal de células claras. | |||
| Adaptación y actualización de Glenn et al[5], y Pithukpakorn y Glenn.[4] | |||
| Historia familiar compatible con la enfermedad de VHL. | Prueba de DNA para la misma variante patogénica deVHLque se detectó antes en uno o más familiares biológicos afectados. | Cuando se desconoce la variante patogénica deVHLen un familiar biológico | Para establecer el diagnóstico clínico se necesita al menos uno de los siguientes elementos: |
| - Cistoadenoma de epidídimo o de ligamento ancho del útero | |||
| - Hemangioblastoma del SNC | |||
| - ccRCC multifocal | |||
| - Feocromocitoma | |||
| - Hemangioblastoma de retina | |||
| - Tumor neuroendocrino de páncreas | |||
| - Quistes pancreáticos o cistoadenoma | |||
| - Tumor de saco endolinfático | |||
| Sin historia familiar compatible con enfermedad de VHL | Es posible que se obtengan resultados negativos en las pruebas genéticas si la variante patogénica deVHLes poscigótica (por ejemplo, mosaicismo deVHL) | Cuando se desconoce la variante patogénica deVHLo se obtuvo un resultado negativo en la prueba germinal, pero hay signos clínicos de enfermedad de VHL | Para establecer el diagnóstico clínico se necesita al menos uno de los siguientes elementos: |
| - Hemangioblastoma del SNC | |||
| - Hemangioblastoma de retina | |||
| Si solo se presenta una de las opciones anteriores, también se debe observar uno de los siguientes elementos para establecer el diagnóstico clínico: | |||
| - ccRCC | |||
| - Feocromocitoma | |||
| - Quistes pancreáticos o cistoadenoma | |||
| - Tumor de saco endolinfático | |||
| - Cistoadenoma de epidídimo o de ligamento ancho del útero | |||
Pruebas genéticas para la enfermedad de Von Hippel-Lindau
Se recomienda informar a los familiares en riesgo sobre la posibilidad de hacer pruebas genéticas para la detección de la enfermedad de VHL. A cualquier familiar con diagnóstico clínico de enfermedad de VHL, o con signos o síntomas de esta enfermedad, por lo general, se le ofrecen primero pruebas genéticas. En más del 99 % de las familias afectadas por la enfermedad de VHL se detectan variantes patogénicas germinales del gen VHL.
El análisis de la secuencia de los 3 exones detecta variantes de un solo nucleótido en el gen VHL (~72 % de todas las variantes patogénicas).[6] Las deleciones casi siempre se detectan mediante secuenciación de última generación (NGS), y se confirman con micromatrices cromosómicas dirigidas o amplificación múltiple de sondas dependiente de ligamiento. La hibridación genómica comparativa de matrices también se utiliza para identificar desequilibrios genómicos. La evidencia anecdótica indica que la NGS en ocasiones se usa para casos en los que se sospecha mosaicismo después de recibir un resultado negativo en la prueba genética de VHL.[7]
Antes de las pruebas genéticas se proporciona asesoramiento genético. Este tipo de asesoramiento incluye un análisis de las implicaciones médicas, económicas y psicosociales para el paciente y sus familiares consanguíneos. Después de esta orientación, el paciente puede elegir someterse a las pruebas genéticas, tras un consentimiento informado. Se proporciona asesoramiento genético adicional en el momento de notificar los resultados al paciente. Cuando se identifica una variante patogénica de VHL en una familia, los familiares biológicos que obtienen un resultado negativo para la misma variante no son portadores del rasgo (es decir, son verdaderos negativos) y no están predispuestos a manifestaciones de la enfermedad de VHL. Además, los hijos de familiares que obtienen un resultado negativo verdadero tampoco están en riesgo de enfermedad de VHL. Por lo tanto, no necesitan hacerse pruebas clínicas en su vida.[4]
Diagnóstico genético de la enfermedad de Von Hippel-Lindau
La presencia de una variante patogénica germinal del gen VHL se considera suficiente para establecer el diagnóstico genético.
Ese hallazgo predispone a la persona a presentar manifestaciones clínicas de la enfermedad de VHL, y le confiere un riesgo del 50 % de transmitir la variante patogénica de VHL a cada descendente (de cualquier sexo). Se ha establecido una asociación con las manifestaciones clínicas de la enfermedad de VHL para cerca de 400 variantes patogénicas únicas del gen VHL, su presencia verifica la causalidad patogénica de la variante. La evaluación genética para el diagnóstico en una familia que no ha sido sometida a pruebas por lo general comienza en una persona con diagnóstico clínico. Si se identifica una variante patogénica de VHL, esa variante específica se convierte en el marcador de DNA para someter a pruebas a otros familiares biológicos. Algunas personas quizás cumplan con los criterios clínicos de diagnóstico de la enfermedad de VHL, pero no presentan un resultado positivo para una variante patogénica de VHL. Cuando estas personas tampoco tienen una historia familiar compatible con la enfermedad de VHL, es posible que presenten variantes patogénicas de novo o mosaicismo. Esto último se detecta mediante una prueba genética en otros tejidos corporales, como fibroblastos de la piel o células exfoliadas de la mejilla. Para obtener más información, consultar la sección Variantes patogénicas de novo y mosaicismo.
Referencias:
- Choyke PL, Glenn GM, Walther MM, et al.: von Hippel-Lindau disease: genetic, clinical, and imaging features. Radiology 194 (3): 629-42, 1995.
- Maher ER, Yates JR, Harries R, et al.: Clinical features and natural history of von Hippel-Lindau disease. Q J Med 77 (283): 1151-63, 1990.
- Lonser RR, Glenn GM, Walther M, et al.: von Hippel-Lindau disease. Lancet 361 (9374): 2059-67, 2003.
- Pithukpakorn M, Glenn G: von Hippel-Lindau syndrome. Community Oncology 1 (4): 232-43, 2004.
- Glenn GM, Daniel LN, Choyke P, et al.: Von Hippel-Lindau (VHL) disease: distinct phenotypes suggest more than one mutant allele at the VHL locus. Hum Genet 87 (2): 207-10, 1991.
- Stolle C, Glenn G, Zbar B, et al.: Improved detection of germline mutations in the von Hippel-Lindau disease tumor suppressor gene. Hum Mutat 12 (6): 417-23, 1998.
- Coppin L, Grutzmacher C, Crépin M, et al.: VHL mosaicism can be detected by clinical next-generation sequencing and is not restricted to patients with a mild phenotype. Eur J Hum Genet 22 (9): 1149-52, 2014.
Detección temprana de las manifestaciones de la enfermedad de Von Hippel-Lindau
Hay directrices para la detección de las manifestaciones de la enfermedad de VHL. En general, estas recomendaciones parten de la opinión y el consenso de expertos, pero la mayoría de ellas no se basan en la evidencia. Se dispone de varias directrices de detección y vigilancia para la enfermedad de VHL.[1,2,3] Las VHLA Suggested Active Surveillance Guidelines de la VHL Alliance son un ejemplo de un plan de vigilancia adaptado a cada persona con enfermedad de VHL.[3] Estas directrices se fundamentan en el consenso de un grupo de expertos de diferentes disciplinas.[4] Las modalidades del plan de vigilancia de la VHL Alliance se pueden utilizar para guiar las pruebas diagnósticas clínicas iniciales de personas en las que se sospecha enfermedad de VHL (ver el Cuadro 3). También se usan para la vigilancia periódica de personas en riesgo con el fin de detectar neoplasias relacionadas con la enfermedad de VHL en un estadio temprano. Se recomiendan exámenes de detección periódicos presintomáticos para las personas en riesgo, es decir aquellas con resultado positivo para una variante patogénica de VHL y aquellas que decidieron no someterse a la prueba para una variante patogénica de VHL, pero tienen familiares biológicos con esta enfermedad. El riesgo de heredar una variante patogénica de VHL en estas personas llega hasta el 50 %.
| Prueba o análisis | Afección a detectar |
|---|---|
| SNC = sistema nervioso central; CAI = canal auditivo interno; IRM = imágenes por resonancia magnética. | |
| a Adaptación de la VHL Alliance.[3] | |
| b Los antecedentes y el examen físico apropiados para la edad incluyen los siguientes aspectos: examen neurológico, preguntas y pruebas auditivas y vestibuloneurales, síntomas visuales, evaluación de los síntomas del exceso de catecolaminas (cefaleas, palpitaciones, diaforesis, hiperactividad, ansiedad, poliuria y dolor abdominal). | |
| Antecedentes y examen físicob | Todas las afecciones enumeradas en este cuadro |
| Examen ocular en persona mediante oftalmoscopia con dilatación | Hemangioblastoma de retina |
| Medición de la presión arterial y el pulso, metanefrinas libres en plasma o metanefrinas fraccionadas libres en orina de 24 horas | Feocromocitoma o paraganglioma |
| IRM del encéfalo y la columna vertebral completa con contraste o sin este | Hemangioblastoma del SNC |
| IRM del abdomen con contraste o sin este | Carcinoma de células renales, feocromocitoma o paraganglioma, tumor o quiste neuroendocrino de páncreas |
| Examen audiológico, IRM del CAI | Tumor de saco endolinfático |
Nivel de evidencia: 5
Detección de los feocromocitomas
Es posible la detección temprana de los feocromocitomas cuando se realizan pruebas clave como las concentraciones de catecolaminas y metanefrinas y las imágenes abdominales transversales. La mayoría de los feocromocitomas pequeños (≤1 cm) tienen concentraciones indetectables de catecolaminas o metanefrinas, pero estas concentraciones pueden aumentar con la progresión del tumor.[5]
Pruebas bioquímicas para los feocromocitomas
Las pruebas bioquímicas son esenciales para la evaluación de las personas con enfermedad de VHL, ya que las concentraciones de metabolitos a menudo se elevan en ausencia de hallazgos anatómicos en las imágenes. La evaluación comienza en la niñez; algunas pautas recomiendan iniciarlas a los 5 años de edad (Cuadro 3). Los profesionales clínicos tienen la opción de obtener pruebas en plasma, en orina o de ambos tipos. Las concentraciones de catecolaminas varían mucho con la alimentación y el uso de medicamentos. Sin embargo, se sugiere medir sus metabolitos, como las metanefrinas, debido a mediciones de rendimiento más altas que las de las catecolaminas. La elevación cuádruple o superior de las metanefrinas indica la presencia de feocromocitoma o paraganglioma.[6] Las personas con feocromocitomas asociados a la enfermedad de VHL a menudo solo tienen normetanefrinas, mientras que los feocromocitomas relacionados con otros síndromes endocrinos presentan un perfil funcional diferente.[7] Para obtener más información en inglés sobre las pruebas bioquímicas para los feocromocitomas, consultar la sección Clinical Diagnosis of PGL and PHEO en Genetics of Endocrine and Neuroendocrine Neoplasias.
Pruebas con imágenes para los feocromocitomas
Las imágenes transversales se obtienen desde el principio de la 2. década de vida para evaluar los riñones, las glándulas suprarrenales y el páncreas. Las imágenes por resonancia magnética (IRM) y por tomografía computarizada (TC) son métodos con excelentes características de rendimiento para la detección de feocromocitomas, su sensibilidad supera el 90 %.[8] Es posible que otros estudios con imágenes sean de utilidad clínica cuando los estudios bioquímicos aumentan la sospecha clínica de feocromocitomas o paragangliomas, pero el paciente no tiene lesiones visibles. Si bien la mayoría de los tumores que surgen en el tejido cromafín en la enfermedad de VHL son feocromocitomas, también se presentan paragangliomas en el tórax, el abdomen, la pelvis, la cabeza o el cuello.[7] Es posible obtener imágenes transversales específicas en estas áreas además de las imágenes funcionales de todo el cuerpo. Para obtener más información en inglés sobre los métodos de imagenología para los feocromocitomas esporádicos y hereditarios, consultar la sección Clinical Diagnosis of PGL and PHEO en Genetics of Endocrine and Neuroendocrine Neoplasias. Los estudios funcionales como las gammagrafías (medicina nuclear) o la tomografía por emisión de positrones (TEP), son útiles para localizar feocromocitomas cuando la sospecha es elevada y no se detecta tumor en la TC o IRM. El rendimiento de las imágenes varía según la ubicación del tumor y los antecedentes genéticos (es decir, el tipo de síndrome de cáncer hereditario o variante genética comprometida). La gammagrafía con yodo I 123-metayodobencilguanidina acompañada de TC proporciona información anatómica y funcional con buena sensibilidad (80–90 %) y especificidad (95–100 %).[9] Otros métodos como la TEP y la TC con flúor F 18 (18F)-fluorodopa y 18F-fludesoxiglucosa también son muy útiles para la detección de tumores.[10]
Detección de los tumores de saco endolinfático
Los tumores de saco endolinfático a menudo causan disfunción audiovestibular permanente. La identificación temprana y el tratamiento de estos tumores pueden disminuir significativamente la morbilidad. Por lo general, la detección de los tumores de saco endolinfático incluye evaluación clínica, audiograma y pruebas con imágenes. La guía de consenso de expertos de la VHL Alliance sobre las recomendaciones para la detección de los tumores de saco endolinfático se fundamenta en la evidencia disponible.[3] Dado que los tumores de saco endolinfático en personas con enfermedad de VHL aparecen a una edad promedio de 30 años (intervalo, 6–62 años), se recomienda que los exámenes de detección comiencen a los 11 años. Una historia clínica exhaustiva puede identificar a los pacientes con síntomas audiovestibulares comunes, como acúfenos, vértigo, sensación de plenitud auditiva e hipoacusia. También se recomienda una evaluación clínica anual a partir de los 11 años de edad, con análisis adicionales si se notifican síntomas nuevos.[11] Los audiogramas de diagnóstico pueden identificar la hipoacusia en varias frecuencias. Se recomiendan audiogramas cada 2 años a partir de los 11 años. Sin embargo, la especificidad para la identificación de tumores de saco endolinfático es baja, ya que la hipoacusia es común en la población general. Aunque, cabe destacar, que la hipoacusia a menudo se presenta a edades más tempranas en pacientes con enfermedad de VHL que tienen tumores de saco endolinfático.[12] Si bien es poco frecuente, se notificó la identificación de tumores de saco endolinfático antes de realizar pruebas con imágenes.[11] Si se presentan síntomas clínicos de tumores de saco endolinfático o el paciente tiene un audiograma anormal, se recomienda una evaluación adicional mediante pruebas con imágenes. La IRM es la prueba más importante para identificar los tumores de saco endolinfático pequeños. Si bien una IRM del encéfalo es útil, una IRM con cortes delgados del canal auditivo interno puede identificar lesiones de mínimo 2 mm de tamaño y tiene una especificidad diagnóstica alta.[13] La hemorragia intralaberíntica, la hidropesía endolinfática y el realce de los tejidos blandos son hallazgos típicos relacionados con los tumores de saco endolinfático. Se sugiere una IRM inicial del canal auditivo interno entre los 15 y los 20 años de edad para evaluar las características anatómicas.[11] Se recomienda prestar especial atención al oído interno en las imágenes encefálicas de rutina que forman parte de las evaluaciones del hemangioblastoma. Una TC de cortes delgados del hueso temporal es otra modalidad útil para confirmar los tumores de saco endolinfático. Si bien esta modalidad de detección puede ayudar a la planificación preoperatoria, tiene los riesgos inherentes de la radiación. La detección de los tumores de saco endolinfático después de los 65 años tienen un beneficio cuestionable, ya que no se han notificado pacientes de más de 62 años con este tipo de tumores.
Referencias:
- Wolters WPG, Dreijerink KMA, Giles RH, et al.: Multidisciplinary integrated care pathway for von Hippel-Lindau disease. Cancer 128 (15): 2871-2879, 2022.
- Binderup MLM, Smerdel M, Borgwadt L, et al.: von Hippel-Lindau disease: Updated guideline for diagnosis and surveillance. Eur J Med Genet 65 (8): 104538, 2022.
- VHL Alliance: VHLA Suggested Active Surveillance Guidelines. Boston, MA: VHL Alliance, 2020. Available online. Last accessed October 22, 2024.
- Daniels AB, Tirosh A, Huntoon K, et al.: Guidelines for surveillance of patients with von Hippel-Lindau disease: Consensus statement of the International VHL Surveillance Guidelines Consortium and VHL Alliance. Cancer 129 (19): 2927-2940, 2023.
- Sanford T, Gomella PT, Siddiqui R, et al.: Long term outcomes for patients with von Hippel-Lindau and Pheochromocytoma: defining the role of active surveillance. Urol Oncol 39 (2): 134.e1-134.e8, 2021.
- Neary NM, King KS, Pacak K: Drugs and pheochromocytoma--don't be fooled by every elevated metanephrine. N Engl J Med 364 (23): 2268-70, 2011.
- Shuch B, Ricketts CJ, Metwalli AR, et al.: The genetic basis of pheochromocytoma and paraganglioma: implications for management. Urology 83 (6): 1225-32, 2014.
- Čtvrtlík F, Koranda P, Schovánek J, et al.: Current diagnostic imaging of pheochromocytomas and implications for therapeutic strategy. Exp Ther Med 15 (4): 3151-3160, 2018.
- Ilias I, Pacak K: Current approaches and recommended algorithm for the diagnostic localization of pheochromocytoma. J Clin Endocrinol Metab 89 (2): 479-91, 2004.
- Ilias I, Meristoudis G: Functional Imaging of Paragangliomas with an Emphasis on Von Hippel-Lindau-Associated Disease: A Mini Review. J Kidney Cancer VHL 4 (3): 30-36, 2017.
- Mehta GU, Kim HJ, Gidley PW, et al.: Endolymphatic Sac Tumor Screening and Diagnosis in von Hippel-Lindau Disease: A Consensus Statement. J Neurol Surg B Skull Base 83 (Suppl 2): e225-e231, 2022.
- Poulsen ML, Gimsing S, Kosteljanetz M, et al.: von Hippel-Lindau disease: surveillance strategy for endolymphatic sac tumors. Genet Med 13 (12): 1032-41, 2011.
- Butman JA, Nduom E, Kim HJ, et al.: Imaging detection of endolymphatic sac tumor-associated hydrops. J Neurosurg 119 (2): 406-11, 2013.
Tratamiento de las manifestaciones de la enfermedad
Tratamiento de los tumores renales
Intervenciones quirúrgicas para los tumores renales
El tratamiento de la enfermedad de Von Hippel-Lindau (VHL) fue cambiando mucho a medida que los profesionales clínicos aprendían a equilibrar el riesgo de diseminación del cáncer al mismo tiempo que reducían la morbilidad renal. En algunas de las series quirúrgicas iniciales se usó la nefrectomía radical bilateral seguida de trasplante renal como tratamiento de tumores renales[1,2] Aunque es poco frecuente, algunos pacientes con enfermedad de VHL se someten a cirugías renales repetidas, lo que, con el tiempo, los vuelve dependientes de la terapia de reemplazo renal. Los trasplantes renales son inocuos en los pacientes con enfermedad de VHL, y los resultados de supervivencia del injerto son satisfactorios.[3] Sin embargo, la conservación de los riñones se ha convertido en una prioridad durante estos procedimientos. En la década de 1980 se introdujo la cirugía conservadora de nefronas para la enfermedad de VHL después de que varios grupos demostraron que este abordaje quirúrgico menos radical se asocia con un riesgo bajo de diseminación del cáncer.[4,5] En 1995, en una gran serie multiinstitucional se demostró que la cirugía conservadora de nefronas conlleva una excelente supervivencia específica del cáncer en pacientes con carcinoma de células renales (RCC).[6] Debido a múltiples informes de desenlaces excelentes, la cirugía conservadora de nefronas ahora se considera el estándar de atención quirúrgica para el RCC relacionado a la enfermedad de VHL, cuando es posible desde el punto de vista técnico. Con el tiempo, se han perfeccionado las técnicas de cirugía conservadora de nefronas para los pacientes con enfermedad de VHL a fin de minimizar el daño al parénquima normal adyacente. Por ejemplo, en la cirugía conservadora de nefronas tradicional, se extrae un margen amplio de tejido. Sin embargo, con un tipo posterior de cirugía conservadora de nefronas llamado enucleación, es posible conservar gran parte del parénquima normal adyacente.[7]
Los pacientes con enfermedad de VHL en ocasiones tienen docenas de tumores renales. Por lo tanto, la resección de toda la enfermedad renal evidente no siempre es posible. Con el fin de reducir al mínimo la morbilidad derivada de múltiples procedimientos quirúrgicos, la disminución del funcionamiento renal y el riesgo de progresión a distancia, se ha buscado un método que equilibre el tratamiento para evitar sobretratar o subtratar. El Instituto Nacional del Cáncer (NCI) evaluó un umbral específico de tamaño tumoral como desencadenante para llevar a cabo la intervención quirúrgica. En una evaluación de 52 pacientes con enfermedad de VHL o carcinoma renal papilar hereditario tratados cuando la lesión renal sólida más grande alcanzó los 3 cm, se demostró la ausencia de evidencia de metástasis a distancia o necesidad de terapia de reemplazo renal al cabo de una mediana de seguimiento de 60 meses.[8] En series retrospectivas posteriores se reforzó la importancia de este umbral de tamaño tumoral de 3 cm. Por ejemplo, en un estudio, ninguno de los 108 pacientes con enfermedad de VHL exhibió indicios de diseminación a distancia cuando el tamaño de los tumores tratados era de 3 cm o inferior.[9] En los pacientes con tumores que medían más de 3 cm, el 27,3 % (20 de 73) presentó recidivas a distancia.[9] Este umbral de tamaño tumoral de 3 cm se usa de manera generalizada en los Estados Unidos con el fin de definir el momento de la intervención quirúrgica para los pacientes con carcinomas renales de células claras (ccRCC) relacionados con la enfermedad de VHL. Sin embargo, algunos grupos de investigación internacionales han publicado datos que respaldan la vigilancia activa de los tumores renales hasta que alcanzan los 4 cm.[10,11,12,13] Cuando se opera a un paciente con enfermedad de VHL, es posible que la resección de tantos tumores renales como sea posible desde el punto de vista clínico retrase la necesidad de más intervenciones quirúrgicas.[14] La ecografía intraoperatoria es útil para identificar y extirpar las lesiones más pequeñas.[15]
Muchos pacientes con enfermedad de VHL continuamente están desarrollando nuevos RCC y es posible que necesiten más intervenciones. Las adherencias y las cicatrices perinéfricas hacen que los procedimientos quirúrgicos subsiguientes sean más difíciles. Si bien se podría considerar una nefrectomía radical, la cirugía conservadora de nefronas sigue siendo el abordaje preferido, cuando es posible. Aunque quizás la incidencia de complicaciones sea más alta con la cirugía conservadora de nefronas repetida y de rescate, es posible que esto permita mantener un funcionamiento renal excelente y desenlaces oncológicos favorables durante el seguimiento intermedio.[16,17] Es mejor que estas cirugías se lleven a cabo en centros especializados con gran experiencia en la atención de personas con formas hereditarias de cáncer de riñón.[18]
Nivel de evidencia: 3di
Procedimientos de ablación para tumores renales
Con las técnicas de ablación térmica se aplica calor o frío extremos en una masa para destruirla. La crioablación (CA) y la ablación por radiofrecuencia (ARF) se usaron por primera vez para el tratamiento de masas renales pequeñas a finales de la década de 1990.[19,20] En el caso de masas renales esporádicas, ambos procedimientos de ablación térmica logran la misma tasa de supervivencia sin recidiva, de cerca del 90 %, lo que hizo que la American Urologic Association recomendara que se tuvieran en cuenta para los pacientes de riesgo alto con masas renales pequeñas (≤4 cm).[21] Las aplicaciones clínicas de los procedimientos de ablación en pacientes con enfermedad de VHL no se han definido con claridad, y la cirugía continúa siendo la intervención más estudiada. Los procedimientos de ablación se usaron por primera vez para el tratamiento del RCC asociado a la enfermedad de VHL en un ensayo de fase II en el que se investigaron los efectos de la ablación en el momento de la resección de la lesión. En este estudio, se trataron 11 tumores, y se corroboró la eliminación del flujo sanguíneo a los tumores mediante ecografía intraoperatoria. En el análisis de patología definitivo se confirmó el efecto terapéutico en todos los tumores.[22] Desde entonces, algunos centros han empezado a utilizar con éxito los procedimientos de ablación térmica para el tratamiento primario y de rescate de pacientes con enfermedad de VHL.[23] En otros centros se encontró que procedimientos como la ARF exhiben una tasa alta de fracaso y se deben reservar para los pacientes con un funcionamiento renal marginal.[24] A pesar de la falta de datos a largo plazo, estos procedimientos se han empezado a usar cada vez más para el tratamiento del RCC en pacientes con enfermedad de VHL.[25,26] En un estudio de una sola institución se evaluaron las tendencias del tratamiento del RCC en 113 pacientes con enfermedad de VHL. Entre 2004 y 2009, el 43 % de los casos se trató con ARF.[26]
Es posible que la ablación térmica desempeñe una función cada vez más importante como terapia de rescate para las personas con un riesgo alto de morbilidad quirúrgica. La CA se evaluó como un tratamiento de rescate en una serie de 14 pacientes para evitar la morbilidad relacionada con la repetición de la cirugía conservadora de nefronas. Los resultados mostraron un cambio mínimo en el funcionamiento renal después del tratamiento con CA. Solo se sospechó recidiva en 4 de 33 tumores (12,1 %) al cabo de una mediana de seguimiento de 37 meses.[27] No obstante, la cirugía después de una ablación térmica es compleja y produce una tasa significativamente más alta de dificultades posoperatorias debido a las adherencias y la cicatrización, en especial, a lo largo del tracto por donde pasan las sondas de ablación.[28,29,30] Los profesionales clínicos deben tener en cuenta que la ablación térmica podría afectar el tratamiento futuro del RCC en personas más jóvenes, que tal vez necesiten otros tratamientos quirúrgicos durante su vida.[18,31]
En síntesis, las aplicaciones clínicas de los procedimientos de ablación en la enfermedad de VHL no están definidas de forma clara, y la cirugía sigue siendo la intervención más estudiada. La evidencia clínica disponible indica que los procedimientos ablativos solo se recomiendan para masas renales pequeñas (≤3 cm) con realce sólido en pacientes de edad avanzada con riesgo quirúrgico alto, en especial aquellos que se enfrentan a cirugía renal de rescate debido a una tasa alta de complicaciones. La edad temprana, un tamaño de tumor superior a 4 cm, los tumores hiliares y las lesiones quísticas se consideran contraindicaciones relativas para la ablación térmica.[32,33]
Nivel de evidencia: 3di
Tratamiento de los feocromocitomas
Vigilancia de los feocromocitomas
Los feocromocitomas a veces son una fuente significativa de morbilidad en los pacientes con enfermedad de VHL porque el exceso de catecolaminas puede provocar efectos cardiovasculares importantes.[34] Es posible, vigilar de manera inocua muchos feocromocitomas pequeños y asintomáticos (≤2 cm) porque tienen tasas de crecimiento y progresión muy lentas. Sin embargo, debido a que en ocasiones los feocromocitomas de personas con la enfermedad de VHL se vuelven malignos (5–10 % metastatizan), es esencial que se realice vigilancia muy estrecha con el fin de garantizar que haya tiempo suficiente para la intervención. Dado que la adrenalectomía parcial es la mejor opción quirúrgica para los feocromocitomas más pequeños, se debe considerar el tamaño y la ubicación anatómica de los mismos cuando se elige el método de vigilancia. Es posible que se necesiten consideraciones especiales para los pacientes que se someterán a futuras cirugías o a un parto. Cuando no se administra un tratamiento alfabloqueante preoperatorio en pacientes con un feocromocitoma, estos pacientes pueden experimentar una liberación masiva de catecolaminas, lo que a veces conlleva inestabilidad hemodinámica.
Intervenciones quirúrgicas para los feocromocitomas
La resección quirúrgica es una herramienta importante para el tratamiento de los feocromocitomas en personas con enfermedad de VHL. Es importante que se obtengan evaluaciones endocrinas detalladas en todos los pacientes y que se administre tratamiento alfabloqueante antes de la resección quirúrgica de los feocromocitomas. A menudo, los medicamentos se deben iniciar y ajustar poco a poco antes de la cirugía para prevenir complicaciones cardiovasculares potencialmente mortales. Para obtener más información en inglés, consultar la sección Preoperative management en Genetics of Endocrine and Neuroendocrine Neoplasias.
Los feocromocitomas en los pacientes con enfermedad de VHL quizás se traten de manera diferente a como se tratan en los pacientes con tumores esporádicos o que tienen otros síndromes de cáncer hereditario. Dado que los feocromocitomas son multifocales y bilaterales en casi el 50 % de los casos en personas con enfermedad de VHL, muchos pacientes se han sometido a una adrenalectomía bilateral y han necesitado reemplazo de corticoesteroides de por vida.[35] La morbilidad relacionada con el reemplazo hormonal de las glándulas suprarrenales y el desarrollo del síndrome de Cushing en personas con enfermedad de VHL ha aumentado el interés por la adrenalectomía parcial con conservación de la corteza. La glándula suprarrenal puede conservarse incluso después de gran movilización y resección tumoral puesto que esta glándula tiene mucha irrigación arterial colateral, además de drenaje venoso.[36] Se necesita conservar de un 15 % a un 30 % del volumen residual de la glándula para producir suficientes hormonas.[37] Usando los procedimientos modernos, la mayoría de las glándulas suprarrenales siguen produciendo cortisol después de una adrenalectomía parcial con conservación de corteza. Cuando queda una glándula suprarrenal solitaria, en una serie se demostró que solo 1 de 13 (8 %) pacientes necesitó reemplazo de corticoesteroides de por vida.[38]
La posibilidad de una adrenalectomía parcial donde quede cáncer residual es una preocupación para los pacientes con feocromocitoma maligno. Sin embargo, en la población con enfermedad de VHL, la tasa de neoplasia maligna para los feocromocitomas es baja (<5 %).[39] La tasa de recidiva local de los feocromocitomas después de una adrenalectomía parcial también es baja (0–33 %). Por lo tanto, cuando es posible y seguro desde el punto de vista oncológico, la mayoría de las directrices recomiendan una adrenalectomía parcial para el tratamiento de los feocromocitomas en pacientes con enfermedad de VHL.
Si se hace una adrenalectomía total, la vena suprarrenal se suele dividir temprano para limitar la liberación de catecolaminas durante la movilización de la glándula. Sin embargo, en una adrenalectomía parcial, la división de la vena suprarrenal puede provocar congestión venosa y compromiso de la glándula.[40] En un paciente con un bloqueo preoperatorio de catecolaminas eficaz, es posible que solo se necesite el pinzamiento de la vena suprarrenal durante la resección y luego, su liberación después de la extirpación del tumor. No está clara la cantidad óptima de parénquima normal adyacente que se debe extirpar. El abordaje quirúrgico inicial con adrenalectomía parcial en pacientes con tumores en la cola o la cabeza de la glándula suprarrenal incluye la extirpación de esta porción de la glándula. Sin embargo, en los pacientes con tumores en el cuerpo de la glándula suprarrenal, esta región se resecó junto con un borde delgado de parénquima normal. A medida que se han aclarado más los datos sobre el riesgo de neoplasia maligna y recidiva local de los feocromocitomas en pacientes con enfermedad de VHL, se ha descrito una técnica que implica una resección enucleativa de la pseudocápsula del tumor (que es similar a las técnicas de enucleación del tumor renal). Este abordaje permite conservar la mayor cantidad de tejido cortical y limitar el compromiso vascular de la glándula suprarrenal residual.[35] No obstante, las preocupaciones por una tasa más alta de recidiva local quizás limiten la aplicación de este abordaje.
Los abordajes quirúrgicos de resección abierta y laparoscópica son inocuos, pero se prefiere la extirpación por laparoscopia siempre que sea posible.[41,42] Los medios de exposición y el abordaje quirúrgico se basan en la ubicación anatómica del tumor. El acceso directo a la glándula suprarrenal y la región paraórtica se logra mediante un abordaje quirúrgico posterior, que es directo, inocuo y eficiente.[43] La exposición adecuada del tumor completo es importante para la extirpación total. Es posible usar asistencia robótica en casos seleccionados porque permite una vista tridimensional y magnificada del área anatómica del tumor.[44] Cuando una persona se ha sometido a varios procedimientos abdominales, a menudo no es factible un abordaje mínimamente invasivo debido a las adherencias. Por lo general, se recomienda la resección abierta para los pacientes con tumores suprarrenales grandes porque la laparoscopia es difícil de realizar dentro de un espacio confinado y aumenta el riesgo de complicaciones. Para obtener más información en inglés sobre los abordajes quirúrgicos para los feocromocitomas, consultar la sección Surgery en Genetics of Endocrine and Neuroendocrine Neoplasias.
Tratamiento de las manifestaciones pancreáticas
Los tumores relacionados con la enfermedad de VHL, como los tumores neuroendocrinos de páncreas, a veces se encuentran de manera fortuita al observar una imagen o al aplicar los protocolos de vigilancia de por vida.[45,46] Las características clínicas de las lesiones pancreáticas (es decir, quísticas vs. sólidas, sintomáticas vs. asintomáticas, tamaño) determinan si los pacientes son aptos para un tratamiento conservador con vigilancia por imágenes o si necesitan una intervención quirúrgica.[47]
Evaluación diagnóstica y pruebas con imágenes para las manifestaciones pancreáticas
Los quistes pancreáticos son benignos y casi nunca necesitan intervención. Los quistes pancreáticos en la enfermedad de VHL no muestran realce en las imágenes y no tienen potencial maligno, independientemente del tamaño. La enfermedad quística difusa del páncreas casi nunca afecta el funcionamiento endocrino. En pocas ocasiones, el quiste reemplaza el páncreas normal y a veces causa una pérdida del funcionamiento exocrino. Cuando se presenta distensión abdominal, cólicos, diarrea o dolor abdominal al ingerir comidas grasosas, es posible obtener estudios enzimáticos en la materia fecal para determinar si se indica la administración de suplementos exocrinos. Las lesiones pancreáticas sólidas o mixtas requieren evaluación y tratamiento especializados, ya que pueden ser cistoadenomas o tumores neuroendocrinos de páncreas. La mayoría de los tumores neuroendocrinos de páncreas no son funcionantes, pero se podría considerar la evaluación de laboratorio con marcadores bioquímicos, como la cromogranina A, durante la evaluación diagnóstica o el seguimiento. Las evaluaciones con imágenes por tomografía computarizada (TC) o resonancia magnética (IRM) con contraste son métodos excelentes para caracterizar las lesiones del páncreas. También se ha utilizado la tomografía por emisión de positrones (TEP) o TC con galio Ga 68-dotate para detectar tumores relacionados con la enfermedad de VHL.[48] Las medidas de desempeño varían según el tamaño de la lesión y el momento de la administración del contraste. Cuando las imágenes transversales no son concluyentes, las imágenes funcionales de medicina nuclear pueden ser útiles para ayudar a diagnosticar la enfermedad metastásica o para diferenciar los adenomas microquísticos sólidos de los tumores neuroendocrinos de páncreas sólidos.[49] La ecografía endoscópica es un método muy sensible. Este procedimiento a veces se ofrece a los pacientes que no pueden recibir un contraste intravenoso o cuando hay preocupación de que una lesión sea un adenoma seroso microquístico sólido, en lugar de un cáncer. Es posible obtener muestras tisulares durante un procedimiento endoscópico, pero casi nunca está indicado.
Vigilancia de las manifestaciones pancreáticas
Los cistoadenomas serosos no tienen potencial maligno y es seguro someterlos a observación. La obstrucción local del colédoco o el conducto pancreático es infrecuente con estas lesiones. Los tumores neuroendocrinos de páncreas sólidos tienen un potencial metastásico bajo, y es posible seguirlos con observación cuando son pequeños, localizados y asintomáticos. La duración y el tipo de imágenes del páncreas dependen del centro, pero los principios generales incluyen imágenes cada 1 a 2 años con el mismo método para permitir comparaciones significativas. Las lesiones pancreáticas con tiempo de duplicación lento y tamaño inferior a 3 cm en pacientes que no tienen variantes patogénica en el exón 3 exhiben los desenlaces más favorables.[50] En una revisión de 175 pacientes con enfermedad de VHL, aquellos con tumores de diámetro inferior a 1,2 cm no presentaron metástasis ni necesitaron cirugía.[51] Los pacientes con tumores más grandes (diámetro de 1,2-3,0 cm) y una variante de cambio de sentido en el gen VHL, en comparación con otros tipos de variantes, tuvieron más probabilidades de presentar metástasis o requerir una intervención quirúrgica. El tamaño del tumor, el tipo de variante y el exón afectado cumplirán en el futuro una función en la determinación del tipo de vigilancia en los pacientes con enfermedad de VHL.
Intervenciones quirúrgicas para las manifestaciones pancreáticas
Los quistes pancreáticos rara vez necesitan intervención quirúrgica, excepto cuando ejercen un efecto de masa. En estos casos raros es posible considerar una aspiración o decorticación. Las indicaciones quirúrgicas en los tumores neuroendocrinos de páncreas varían, pero las intervenciones se ofrecen para reducir el riesgo de diseminación. En una revisión de la historia natural de los tumores neuroendocrinos de páncreas se registró que estos tumores a veces presentan características de crecimiento no lineal.[52] Por lo general, los tumores neuroendocrinos de páncreas se extirpan si miden 3 cm o más (o ≥2 cm si el tumor se encuentra en la cabeza del páncreas).[53] La enucleación del tumor es inocua y eficaz si la lesión no se encuentra cerca del conducto pancreático. Si la enucleación de la lesión no es inocua, se lleva a cabo una pancreatectomía distal. Los tumores en la cabeza del páncreas de 2 cm o más, también se evalúan para resección, porque las lesiones más grandes en esta ubicación son más difíciles de enuclear. Si la lesión se encuentra demasiado cerca del conducto pancreático, se ofrece un procedimiento de Whipple. Para las situaciones poco frecuentes de lesiones multifocales grandes, se podría considerar una pancreatectomía total. Después de la cirugía, si los pacientes presentan disfunción exocrina, la administración de suplementos enzimáticos quizás mejore los síntomas digestivos y el estado nutricional.
Si se encuentran ganglios linfáticos comprometidos durante la cirugía, se deben extirpar. En las personas con tumores neuroendocrinos de páncreas localmente avanzados o metastásicos, es posible considerar la cirugía cuando sea posible hacer una citorreducción significativa. Además, las lesiones hepáticas metastásicas a menudo se tratan con procedimientos de ablación local o resección en algunos pacientes con enfermedad de VHL.
Tratamiento de los hemangioblastomas de retina
Intervenciones para los hemangioblastomas de retina
El tratamiento de los hemangioblastomas de retina incluye láser, terapia fotodinámica y vitrectomía. También se han probado terapias sistémicas y locales.
Fotocoagulación con láser.
La fotocoagulación con láser se usa de manera generalizada para tratar los hemangioblastomas de retina en pacientes con enfermedad de VHL. En una revisión retrospectiva de 304 hemangioblastomas de retina tratados en 100 ojos, se observó que la fotocoagulación con láser tuvo una tasa de control superior al 90 % y fue más eficaz en lesiones más pequeñas de hasta 1 disco de diámetro.[54]
Vitrectomía y retinectomía
En 21 pacientes con desprendimiento de retina grave se conservó la visión en grados variables cuando el tratamiento se hizo con vitrectomía a través de la parte plana con desprendimiento hialoideo posterior, disección de la membrana epirretiniana, e inyección de aceite de silicona o gas con retinectomía, fotocoagulación o crioterapia para extirpar el hemangioblastoma de retina.[55] La vitrectomía a través de la parte plana mejoró la función visual o conservó la visión en 23 pacientes con afección ocular avanzada asociada a la enfermedad de VHL.[56] Sin embargo, la progresión posoperatoria de dicha enfermedad quizás se aceleró en los casos tratados con retinotomía.
Terapia fotodinámica
La terapia fotodinámica redujo el edema macular en una serie de casos de 2 pacientes con hemangioblastomas bilaterales de retina.[57] Estos pacientes obtuvieron un beneficio mínimo, con poco o ningún aumento en la agudeza visual. En una segunda serie de 5 pacientes, entre ellos, 4 con enfermedad de VHL, se usó terapia fotodinámica en 6 ojos.[58] Este tratamiento produjo regresión o estabilización tumoral, así como la disminución de la cantidad de líquido subretiniano y exudados lipídicos en todos los pacientes. Sin embargo, la estabilización o mejora de la agudeza visual solo se presentó en el 50 % de los casos.
Tratamiento intravítreo
El tratamiento intravítreo con bevacizumab produjo estabilización de los hemangioblastomas capilares de retina durante más de 2 años en un informe de casos [59] y mejora de la visión en 1 de 5 ojos en otro informe de casos.[60] El ranibizumab intavítreo no produjo mejoría uniforme en una serie de casos en 5 pacientes.[61] El uso de bevacizumab sistémico produjo un beneficio marginal en informes de casos individuales.[62,63] El tratamiento con sunitinib produjo estabilización visual en 3 pacientes, pero también se asoció con toxicidad simultánea significativa.[64]
Terapia de protones
En un estudio de casos donde se usó la terapia de protones en 8 ojos de 8 pacientes, se observó resolución del edema macular en 7 de 8 pacientes. Todos los ojos tratados conservaron la visión después de una mediana de seguimiento de 84 meses.[65]
Tratamiento de los hemangioblastomas del sistema nervioso central
Vigilancia de los hemangioblastomas del sistema nervioso central
Muchas lesiones pequeñas se encuentran de manera fortuita durante la detección sistemática y es posible que los pacientes permanezcan asintomáticos durante un período largo. En un estudio de seguimiento por un corto plazo, del 35,5 % al 51 % de los hemangioblastomas del SNC permanecieron estables.[66]
En una serie de los Institutos Nacionales de la Salud, los investigadores observaron que el modelo de crecimiento de los hemangioblastomas del sistema nervioso central (SNC) varía, pero el más frecuente es el crecimiento saltatorio (72 %).[67] También se observaron otros patrones de crecimiento, como el crecimiento lineal (6 %) y el crecimiento exponencial (22 %). Se han evaluado los determinantes del crecimiento. La ubicación de las lesiones quizás repercuta en el crecimiento, porque las lesiones en el cerebelo y en el tronco encefálico crecen más rápido que las lesiones en la médula espinal o la cola de caballo.[67] Alrededor del 12 % de los pacientes con hemangioblastomas presentaron quistes peritumorales o intratumorales; el 6,4 % eran sintomáticos y necesitaron tratamiento. El aumento de la carga tumoral o del número de tumores detectados se relacionó con el sexo masculino, un tiempo de seguimiento más prolongado y el genotipo específico (todos los casos P < 0,01). Las deleciones germinales parciales se relacionaron con un número mayor de tumores por paciente que las variantes de cambio de sentido (P < 0,01). Se observaron otros hallazgos interesantes, como aumento del número de tumores por año en los pacientes más jóvenes y una tasa de crecimiento tumoral más rápida en los hombres (P < 0,01).
Otra serie pequeña (n = 52) tuvo como objetivo evaluar las tasas de crecimiento de los hemangioblastomas del SNC bajo vigilancia. Los investigadores encontraron que la presencia de síntomas era el único predictor independiente del crecimiento.[66] A medida que la mayoría de los hemangioblastomas del SNC crecen y se vuelven sintomáticos, la tasa de tratamiento también aumenta, con tasas de intervención a 1, 3 y 7 años que alcanzan el 11,5 %, el 50,1 % y el 73 %, respectivamente.
Intervenciones quirúrgicas para los hemangioblastomas del sistema nervioso central
El abordaje de tratamiento estándar ha sido la resección quirúrgica de los hemangioblastomas de cerebelo o de médula espinal. Si bien la resección quirúrgica de los tumores por lo general se realiza antes de la aparición de los síntomas neurológicos,[68] esto varía según el centro y puede que se modifique de acuerdo a ciertos factores como edema, ubicación del tumor, hidrocefalia y tasa de crecimiento del tumor. A menudo, el acceso quirúrgico para las lesiones de la médula espinal es posterior y exige una laminectomía. Debido a que los pacientes suelen necesitar varias operaciones durante la vida, la pérdida de apoyo estructural a veces causa inestabilidad vertebral progresiva y es posible que exija estabilización o fusión.[69] En el caso de lesiones cerebelosas, el abordaje depende de la orientación lateral del tumor, en muchos casos es posible acceder a través de una incisión suboccipital en la línea media. La embolización preoperatoria a veces se hace para reducir la hemorragia, pero este abordaje depende de la preferencia del cirujano.[70]
Radioterapia para los hemangioblastomas del sistema nervioso central
Debido a que los pacientes a veces tienen tumores múltiples y requieren varios procedimientos quirúrgicos, la radioterapia externa se ha convertido en una alternativa cuando no es factible la cirugía de resección. La radiocirugía estereotáctica es un abordaje de uso generalizado para el tratamiento del hemangioblastoma.[71] En series retrospectivas se demostró que la radiocirugía redujo el tamaño de más del 50 % de las lesiones tratadas, con una tasa de complicaciones baja.[71] En un estudio prospectivo del NCI se evaluó el control local de las lesiones tratadas. Es posible que se necesiten series a largo plazo para evaluar la eficacia de la radiocirugía, porque algunos de los tumores exhiben un patrón de crecimiento saltatorio. En esta serie, el 33 % de los tumores asintomáticos tratados de menos de 1 centímetro progresaron durante el seguimiento. Debido a las preocupaciones del control local a largo plazo, los autores concluyeron que la radiocirugía estereotáctica se debe reservar para el tratamiento de los tumores que no se pueden someter a resección quirúrgica.[72] En otras series se observaron mejores desenlaces.[73] Sin embargo, no está claro si esto depende de la definición de control local, que varía entre los estudios.
Tratamiento de los tumores de saco endolinfático
Hay pocos datos sobre el tratamiento de los tumores de saco endolinfático, que en su mayoría provienen de series de casos en donde se describe el tratamiento quirúrgico de tumores esporádicos y tumores asociados a la enfermedad de VHL. Debido a que el compromiso audiovestibular no depende del tamaño del tumor y se puede presentar con tumores pequeños, por lo general se prefiere la intervención temprana. Es posible que la intervención temprana también reduzca al mínimo el riesgo de invasión de las estructuras circundantes y aumente la probabilidad de una resección completa. En un metaanálisis se evaluaron los desenlaces en 82 estudios donde se trataron 252 tumores.[74] Se observó un número limitado de pacientes y casi todos presentaron progresión clínica, lo que genera desconfianza sobre este abordaje. La cirugía ha sido el tratamiento principal para los tumores de saco endolinfático, y la resección completa es la mejor opción para evitar la recidiva. Se ha utilizado la embolización preoperatoria para minimizar el riesgo de morbilidad perioperatoria y hemorragia. El abordaje quirúrgico a menudo depende de la preferencia del cirujano, la ubicación del tumor y del estado auditivo inicial del paciente. La resección completa de la enfermedad no siempre es posible debido a la extensión del tumor y la invasión a las estructuras circundantes. Por lo tanto, las tasas de recidiva de los tumores de saco endolinfático después de la cirugía son altas (16 %). Si bien la radiación no suele ser una opción de tratamiento de primera línea, a menudo se usa como tratamiento adyuvante. Los datos sobre los abordajes de terapia sistémica para los tumores de saco endolinfático son limitados.
Terapia sistémica específica para la enfermedad de Von Hippel-Lindau localizada
Los pacientes con enfermedad de VHL a menudo requieren múltiples tratamientos locales para las manifestaciones de la enfermedad. Las intervenciones quirúrgicas repetidas contribuyen a la morbilidad y, a menudo, pueden causar daños irreversibles en los órganos afectados. Se puede presentar la pérdida permanente de funcionamiento en los siguientes órganos:
- Deterioro visual (retinas).
- Enfermedad renal crónica (riñones).
- Insuficiencia suprarrenal (glándulas suprarrenales).
- Diabetes y deficiencia exocrina pancreática (páncreas).
- Complicaciones neurológicas como alteraciones motoras o sensoriales (encéfalo y columna vertebral).
Los investigadores han buscado una terapia sistémica que reduzca o elimine la necesidad de intervenciones locales. La comprensión de las características biológicas de la enfermedad de VHL ha llevado al desarrollo de terapias dirigidas que interfieren con la cascada de señalización resultante asociada con la tumorogénesis.[75] Primero se desarrollaron fármacos eficaces dirigidos a la vía del factor inducible por hipoxia (HIF) de la enfermedad de VHL para tratar a los pacientes con ccRCC en estadio esporádico avanzado. Más tarde, se investigó la utilidad clínica de estos fármacos en personas con enfermedad de VHL que presentaban diversas manifestaciones relacionadas con la enfermedad.
En la investigación inicial sobre el tratamiento con tanespimicina (17-AAG), se destacó que la administración intravenosa de medicamentos tal vez no sea la preferida por algunos pacientes. La toxicidad modesta y la tolerabilidad deficiente relacionadas con 17-AAG pueden disuadir a los pacientes sanos (con otras opciones quirúrgicas) de usar este tratamiento.[76] Posteriormente, se evaluó una variedad de fármacos dirigidos a la vía del factor de crecimiento endotelial vascular (VEGF). La mayoría de estos fármacos demostraron actividad contra los tumores renales, pero solo una actividad modesta o ausente contra los hemangioblastomas del SNC, los tumores neuroendocrinos de páncreas y otras manifestaciones relacionadas con la enfermedad de VHL. Se administró un inhibidor de tirosina–cinasas de primera generación, el sunitinib, a pacientes con enfermedad de VHL durante un máximo de 4 ciclos (se administró durante 4 semanas, y luego se dieron 2 semanas de descanso). Este medicamento se evaluó por primera vez en una cohorte de 15 participantes con diversas manifestaciones relacionadas con la enfermedad de VHL; ninguno de los participantes necesitaba intervención médica inmediata.[77] Si bien los tumores no crecieron en estas personas (>90 % de los participantes), la toxicidad (incluso fatiga) condujo a reducciones frecuentes de la dosis de sunitinib en 10 de 15 participantes. La tasa de respuesta general (TRG) fue del 33 % (6 de 18 tumores) en los tumores renales localizados, lo que demuestra la posibilidad de que el tratamiento con sunitinib influya sobre la necesidad de intervención local. Desafortunadamente, no se observaron respuestas (según lo definido por los Response Evaluation Criteria in Solid Tumors [RECIST]) en los hemangioblastomas del SNC. En una revisión retrospectiva de 14 pacientes que habían recibido sunitinib, no se observaron respuestas en 11 pacientes con hemangioblastomas de cerebelo y 8 pacientes con hemangioblastomas de médula espinal.[78] En un estudio de fase II con 37 pacientes, se evaluó el vandetanib, un inhibidor de tirosina–cinasas con una especificidad amplia por varias dianas (incluso el receptor del factor de crecimiento endotelial vascular [VEGFR] y el receptor del factor de crecimiento epidérmico [EGFR]). En este estudio, el vandetanib se relacionó con actividad limitada y toxicidad, lo que requirió interrupciones frecuentes del tratamiento y reducciones de la dosis.[79] El pazopanib, un inhibidor de tirosina–cinasas de segunda generación con un perfil de toxicidad mejor que el del sunitinib, se estudió de manera similar en pacientes con enfermedad de VHL.[80] Una cohorte de 31 pacientes se trató con pazopanib durante 24 semanas con la opción de continuar recibiendo este tratamiento. Se observaron respuestas (de acuerdo a las definiciones de RECIST) en el 52 % de los tumores renales y el 53 % de las lesiones pancreáticas. En este estudio se incluyeron tumores neuroendocrinos de páncreas malignos y cistoadenomas serosos pancreáticos benignos. Sin embargo, hubo poca actividad contra los hemangioblastomas del SNC, y se observó una TRG del 4 %. El pazopanib también se toleró de manera precaria; solo el 23 % de los participantes optaron por continuar el tratamiento más allá del período inicial de 24 semanas.
Si bien la terapia anti-VEGF se administra de manera sistémica para la mayoría de las neoplasias relacionadas con la enfermedad de VHL, se puede administrar directamente en el ojo en casos de tumores de retina relacionados con esta enfermedad. Se evaluó la administración intravítrea del pegaptanib (terapia anti-VEGF) en 5 pacientes con hemangioblastomas de retina relacionados con la enfermedad de VHL.[81] Solo 2 pacientes pudieron completar el tratamiento con pegaptanib y no se observaron respuestas en los tumores primarios de los pacientes. Dos pacientes presentaron disminución del engrosamiento de la retina y un número reducido de exudados duros. Si bien la Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el pegaptanib para el tratamiento de la degeneración macular, no está aprobado para el tratamiento de las lesiones de retina relacionadas con la enfermedad de VHL.
La investigación dirigida a las consecuencias del aumento regulado de HIF (debido a la inactivación del gen VHL) solo tuvo un éxito moderado. Por lo tanto, los esfuerzos recientes se han centrado en abordar las consecuencias directas de la pérdida de actividad del gen VHL. En muchos estudios se demostró que múltiples moléculas de HIF regulan de manera diferenciada la carcinogénesis, y que HIF2 es el mediador más crítico.[82] Este factor de transcripción se convirtió en una diana prometedora para el tratamiento, pero esto solo fue posible cuando se desarrolló una nueva clase de fármacos que pueden inhibir de manera selectiva el HIF2-α. Estos fármacos se diseñaron para encajar en el bolsillo de unión del dominio per-ARNT-SIM (PAS)-B de HIF2-α. Esto evitó la dimerización de HIF1-β con ARNT y mostró actividad en modelos de laboratorio.[83] En última instancia, esto condujo al desarrollo de belzutifán, un fármaco oral que se evaluó en un estudio internacional de fase II llevado a cabo en 11 centros con participación de 61 pacientes con RCC asociado a la enfermedad de VHL.[84] A diferencia de los fármacos dirigidos a la vía del VEGF, el belzutifán se toleró bien en los participantes y tuvo una tasa baja de toxicidad de grado alto. El acontecimiento adverso de grado 3 más común fue la anemia (8 % de los pacientes) y la mayoría de los pacientes siguieron tomando belzutifán después de la publicación de este artículo (mediana de período de seguimiento, 21,8 meses). Se observaron respuestas en el 49 % de los tumores renales, el 77 % de los tumores de páncreas y el 30 % de los tumores del SNC. Todos los tumores de retina (16/16) mejoraron después del tratamiento con belzutifán. La FDA aprobó el belzutifán para los hemangioblastomas de riñón, de páncreas y del SNC relacionados con la enfermedad de VHL que no requieren intervención quirúrgica inmediata, según las mediciones de actividad y tolerabilidad del ensayo. Se anticipa que otras investigaciones revelarán la eficacia y la toxicidad a largo plazo de este fármaco. El belzutifán se usa ahora como complemento del tratamiento quirúrgico en pacientes con tumores asociados a la enfermedad de VHL que se limitan a un órgano. No está claro cómo se utilizará el belzutifán en la práctica clínica y qué proveedores lo prescribirán a los pacientes.[76]
Tratamiento de la enfermedad de Von Hippel-Lindau durante el embarazo
En 2 estudios se examinó el efecto del embarazo en la progresión del hemangioblastoma en pacientes con enfermedad de Von Hippel-Lindau (VHL).[85,86] En un estudio retrospectivo de los Países bajos se examinaron los registros de 29 pacientes con enfermedad de VHL que quedaron embarazadas 48 veces (49 recién nacidos) entre 1966 y 2010 (40 % quedaron embarazadas antes de 1990). Se obtuvieron registros de las imágenes del 31 % de los embarazos. Los investigadores notificaron que en el 17 % de los embarazos se registraron complicaciones asociadas a la enfermedad de VHL, entre ellos, 3 pacientes con hemangioblastomas craneoespinales que presentaron un cambio significativo en la puntuación de progresión tumoral (P = 0,049) antes y después del embarazo.[85] Sin embargo, los hallazgos de este estudio contrastan con los de una investigación prospectiva pequeña.[86] Hasta que se cuente con un estudio prospectivo internacional de gran escala, estas investigaciones indican el uso de un abordaje conservador que incluya vigilancia médica durante el embarazo.
Referencias:
- Goldfarb DA, Neumann HP, Penn I, et al.: Results of renal transplantation in patients with renal cell carcinoma and von Hippel-Lindau disease. Transplantation 64 (12): 1726-9, 1997.
- Fetner CD, Barilla DE, Scott T, et al.: Bilateral renal cell carcinoma in von Hippel-Lindau syndrome: treatment with staged bilateral nephrectomy and hemodialysis. J Urol 117 (4): 534-6, 1977.
- Antony MB, Rompré-Brodeur A, Chaurasia A, et al.: Outcomes of and indications for renal transplantation in patients with von Hippel Lindau disease. Urol Oncol 41 (12): 487.e1-487.e6, 2023.
- Pearson JC, Weiss J, Tanagho EA: A plea for conservation of kidney in renal adenocarcinoma associated with von Hippel-Lindau disease. J Urol 124 (6): 910-2, 1980.
- Loughlin KR, Gittes RF: Urological management of patients with von Hippel-Lindau's disease. J Urol 136 (4): 789-91, 1986.
- Steinbach F, Novick AC, Zincke H, et al.: Treatment of renal cell carcinoma in von Hippel-Lindau disease: a multicenter study. J Urol 153 (6): 1812-6, 1995.
- Walther MM, Thompson N, Linehan W: Enucleation procedures in patients with multiple hereditary renal tumors. World J Urol 13 (4): 248-50, 1995.
- Walther MM, Choyke PL, Glenn G, et al.: Renal cancer in families with hereditary renal cancer: prospective analysis of a tumor size threshold for renal parenchymal sparing surgery. J Urol 161 (5): 1475-9, 1999.
- Duffey BG, Choyke PL, Glenn G, et al.: The relationship between renal tumor size and metastases in patients with von Hippel-Lindau disease. J Urol 172 (1): 63-5, 2004.
- Peng X, Chen J, Wang J, et al.: Natural history of renal tumours in von Hippel-Lindau disease: a large retrospective study of Chinese patients. J Med Genet 56 (6): 380-387, 2019.
- Zhang J, Pan JH, Dong BJ, et al.: Active surveillance of renal masses in von Hippel-Lindau disease: growth rates and clinical outcome over a median follow-up period of 56 months. Fam Cancer 11 (2): 209-14, 2012.
- Jilg CA, Neumann HP, Gläsker S, et al.: Growth kinetics in von Hippel-Lindau-associated renal cell carcinoma. Urol Int 88 (1): 71-8, 2012.
- Neumann HP, Bender BU, Berger DP, et al.: Prevalence, morphology and biology of renal cell carcinoma in von Hippel-Lindau disease compared to sporadic renal cell carcinoma. J Urol 160 (4): 1248-54, 1998.
- Fadahunsi AT, Sanford T, Linehan WM, et al.: Feasibility and outcomes of partial nephrectomy for resection of at least 20 tumors in a single renal unit. J Urol 185 (1): 49-53, 2011.
- Choyke PL, Pavlovich CP, Daryanani KD, et al.: Intraoperative ultrasound during renal parenchymal sparing surgery for hereditary renal cancers: a 10-year experience. J Urol 165 (2): 397-400, 2001.
- Bratslavsky G, Liu JJ, Johnson AD, et al.: Salvage partial nephrectomy for hereditary renal cancer: feasibility and outcomes. J Urol 179 (1): 67-70, 2008.
- Johnson A, Sudarshan S, Liu J, et al.: Feasibility and outcomes of repeat partial nephrectomy. J Urol 180 (1): 89-93; discussion 93, 2008.
- Shuch B, Linehan WM, Bratslavsky G: Repeat partial nephrectomy: surgical, functional and oncological outcomes. Curr Opin Urol 21 (5): 368-75, 2011.
- Gill IS, Novick AC, Soble JJ, et al.: Laparoscopic renal cryoablation: initial clinical series. Urology 52 (4): 543-51, 1998.
- McGovern FJ, Wood BJ, Goldberg SN, et al.: Radio frequency ablation of renal cell carcinoma via image guided needle electrodes. J Urol 161 (2): 599-600, 1999.
- Campbell SC, Novick AC, Belldegrun A, et al.: Guideline for management of the clinical T1 renal mass. J Urol 182 (4): 1271-9, 2009.
- Walther MC, Shawker TH, Libutti SK, et al.: A phase 2 study of radio frequency interstitial tissue ablation of localized renal tumors. J Urol 163 (5): 1424-7, 2000.
- Shingleton WB, Sewell PE: Percutaneous renal cryoablation of renal tumors in patients with von Hippel-Lindau disease. J Urol 167 (3): 1268-70, 2002.
- Park BK, Kim CK: Percutaneous radio frequency ablation of renal tumors in patients with von Hippel-Lindau disease: preliminary results. J Urol 183 (5): 1703-7, 2010.
- Chan VW, Lenton J, Smith J, et al.: Multimodal image-guided ablation on management of renal cancer in Von-Hippel-Lindau syndrome patients from 2004 to 2021 at a specialist centre: A longitudinal observational study. Eur J Surg Oncol 48 (3): 672-679, 2022.
- Joly D, Méjean A, Corréas JM, et al.: Progress in nephron sparing therapy for renal cell carcinoma and von Hippel-Lindau disease. J Urol 185 (6): 2056-60, 2011.
- Yang B, Autorino R, Remer EM, et al.: Probe ablation as salvage therapy for renal tumors in von Hippel-Lindau patients: the Cleveland Clinic experience with 3 years follow-up. Urol Oncol 31 (5): 686-92, 2013.
- Nguyen CT, Lane BR, Kaouk JH, et al.: Surgical salvage of renal cell carcinoma recurrence after thermal ablative therapy. J Urol 180 (1): 104-9; discussion 109, 2008.
- Karam JA, Wood CG, Compton ZR, et al.: Salvage surgery after energy ablation for renal masses. BJU Int 115 (1): 74-80, 2015.
- Kowalczyk KJ, Hooper HB, Linehan WM, et al.: Partial nephrectomy after previous radio frequency ablation: the National Cancer Institute experience. J Urol 182 (5): 2158-63, 2009.
- Shuch B, Singer EA, Bratslavsky G: The surgical approach to multifocal renal cancers: hereditary syndromes, ipsilateral multifocality, and bilateral tumors. Urol Clin North Am 39 (2): 133-48, v, 2012.
- Dominguez-Escrig JL, Sahadevan K, Johnson P: Cryoablation for small renal masses. Adv Urol : 479495, 2008.
- Aron M, Gill IS: Minimally invasive nephron-sparing surgery (MINSS) for renal tumours. Part II: probe ablative therapy. Eur Urol 51 (2): 348-57, 2007.
- Sanford T, Gomella PT, Siddiqui R, et al.: Long term outcomes for patients with von Hippel-Lindau and Pheochromocytoma: defining the role of active surveillance. Urol Oncol 39 (2): 134.e1-134.e8, 2021.
- Benhammou JN, Boris RS, Pacak K, et al.: Functional and oncologic outcomes of partial adrenalectomy for pheochromocytoma in patients with von Hippel-Lindau syndrome after at least 5 years of followup. J Urol 184 (5): 1855-9, 2010.
- Baghai M, Thompson GB, Young WF, et al.: Pheochromocytomas and paragangliomas in von Hippel-Lindau disease: a role for laparoscopic and cortical-sparing surgery. Arch Surg 137 (6): 682-8; discussion 688-9, 2002.
- Brauckhoff M, Gimm O, Thanh PN, et al.: Critical size of residual adrenal tissue and recovery from impaired early postoperative adrenocortical function after subtotal bilateral adrenalectomy. Surgery 134 (6): 1020-7; discussion 1027-8, 2003.
- Walther MM, Keiser HR, Choyke PL, et al.: Management of hereditary pheochromocytoma in von Hippel-Lindau kindreds with partial adrenalectomy. J Urol 161 (2): 395-8, 1999.
- Fallon SC, Feig D, Lopez ME, et al.: The utility of cortical-sparing adrenalectomy in pheochromocytomas associated with genetic syndromes. J Pediatr Surg 48 (6): 1422-5, 2013.
- Roukounakis N, Dimas S, Kafetzis I, et al.: Is preservation of the adrenal vein mandatory in laparoscopic adrenal-sparing surgery? JSLS 11 (2): 215-8, 2007 Apr-Jun.
- Timmers HJ, Gimenez-Roqueplo AP, Mannelli M, et al.: Clinical aspects of SDHx-related pheochromocytoma and paraganglioma. Endocr Relat Cancer 16 (2): 391-400, 2009.
- Vargas HI, Kavoussi LR, Bartlett DL, et al.: Laparoscopic adrenalectomy: a new standard of care. Urology 49 (5): 673-8, 1997.
- Perrier ND, Kennamer DL, Bao R, et al.: Posterior retroperitoneoscopic adrenalectomy: preferred technique for removal of benign tumors and isolated metastases. Ann Surg 248 (4): 666-74, 2008.
- Dickson PV, Jimenez C, Chisholm GB, et al.: Posterior retroperitoneoscopic adrenalectomy: a contemporary American experience. J Am Coll Surg 212 (4): 659-65; discussion 665-7, 2011.
- Binderup ML, Bisgaard ML, Harbud V, et al.: Von Hippel-Lindau disease (vHL). National clinical guideline for diagnosis and surveillance in Denmark. 3rd edition. Dan Med J 60 (12): B4763, 2013.
- Kruizinga RC, Sluiter WJ, de Vries EG, et al.: Calculating optimal surveillance for detection of von Hippel-Lindau-related manifestations. Endocr Relat Cancer 21 (1): 63-71, 2014.
- Keutgen XM, Hammel P, Choyke PL, et al.: Evaluation and management of pancreatic lesions in patients with von Hippel-Lindau disease. Nat Rev Clin Oncol 13 (9): 537-49, 2016.
- Shell J, Tirosh A, Millo C, et al.: The utility of 68Gallium-DOTATATE PET/CT in the detection of von Hippel-Lindau disease associated tumors. Eur J Radiol 112: 130-135, 2019.
- Sadowski SM, Weisbrod AB, Ellis R, et al.: Prospective evaluation of the clinical utility of 18-fluorodeoxyglucose PET CT scanning in patients with von hippel-lindau-associated pancreatic lesions. J Am Coll Surg 218 (5): 997-1003, 2014.
- Blansfield JA, Choyke L, Morita SY, et al.: Clinical, genetic and radiographic analysis of 108 patients with von Hippel-Lindau disease (VHL) manifested by pancreatic neuroendocrine neoplasms (PNETs). Surgery 142 (6): 814-8; discussion 818.e1-2, 2007.
- Tirosh A, Sadowski SM, Linehan WM, et al.: Association of VHL Genotype With Pancreatic Neuroendocrine Tumor Phenotype in Patients With von Hippel-Lindau Disease. JAMA Oncol 4 (1): 124-126, 2018.
- Weisbrod AB, Kitano M, Thomas F, et al.: Assessment of tumor growth in pancreatic neuroendocrine tumors in von Hippel Lindau syndrome. J Am Coll Surg 218 (2): 163-9, 2014.
- Libutti SK, Choyke PL, Bartlett DL, et al.: Pancreatic neuroendocrine tumors associated with von Hippel Lindau disease: diagnostic and management recommendations. Surgery 124 (6): 1153-9, 1998.
- Krivosic V, Kamami-Levy C, Jacob J, et al.: Laser photocoagulation for peripheral retinal capillary hemangioblastoma in von Hippel-Lindau disease. Ophthalmol Retina 1 (1): 59-67, 2017. Also available online. Last accessed October 22, 2024.
- Gaudric A, Krivosic V, Duguid G, et al.: Vitreoretinal surgery for severe retinal capillary hemangiomas in von hippel-lindau disease. Ophthalmology 118 (1): 142-9, 2011.
- Krzystolik K, Stopa M, Kuprjanowicz L, et al.: PARS PLANA VITRECTOMY IN ADVANCED CASES OF VON HIPPEL-LINDAU EYE DISEASE. Retina 36 (2): 325-34, 2016.
- Papastefanou VP, Pilli S, Stinghe A, et al.: Photodynamic therapy for retinal capillary hemangioma. Eye (Lond) 27 (3): 438-42, 2013.
- Sachdeva R, Dadgostar H, Kaiser PK, et al.: Verteporfin photodynamic therapy of six eyes with retinal capillary haemangioma. Acta Ophthalmol 88 (8): e334-40, 2010.
- Ach T, Thiemeyer D, Hoeh AE, et al.: Intravitreal bevacizumab for retinal capillary haemangioma: longterm results. Acta Ophthalmol 88 (4): e137-8, 2010.
- Slim E, Antoun J, Kourie HR, et al.: Intravitreal bevacizumab for retinal capillary hemangioblastoma: A case series and literature review. Can J Ophthalmol 49 (5): 450-7, 2014.
- Wong WT, Liang KJ, Hammel K, et al.: Intravitreal ranibizumab therapy for retinal capillary hemangioblastoma related to von Hippel-Lindau disease. Ophthalmology 115 (11): 1957-64, 2008.
- von Buelow M, Pape S, Hoerauf H: Systemic bevacizumab treatment of a juxtapapillary retinal haemangioma. Acta Ophthalmol Scand 85 (1): 114-6, 2007.
- Wackernagel W, Lackner EM, Pilz S, et al.: von Hippel-Lindau disease: treatment of retinal haemangioblastomas by targeted therapy with systemic bevacizumab. Acta Ophthalmol 88 (7): e271-2, 2010.
- Knickelbein JE, Jacobs-El N, Wong WT, et al.: Systemic Sunitinib Malate Treatment for Advanced Juxtapapillary Retinal Hemangioblastomas Associated with von Hippel-Lindau Disease. Ophthalmol Retina 1 (3): 181-187, 2017 May-Jun.
- Seibel I, Cordini D, Hager A, et al.: Long-term results after proton beam therapy for retinal papillary capillary hemangioma. Am J Ophthalmol 158 (2): 381-6, 2014.
- Byun J, Yoo HJ, Kim JH, et al.: Growth rate and fate of untreated hemangioblastomas: clinical assessment of the experience of a single institution. J Neurooncol 144 (1): 147-154, 2019.
- Lonser RR, Butman JA, Huntoon K, et al.: Prospective natural history study of central nervous system hemangioblastomas in von Hippel-Lindau disease. J Neurosurg 120 (5): 1055-62, 2014.
- Harati A, Satopää J, Mahler L, et al.: Early microsurgical treatment for spinal hemangioblastomas improves outcome in patients with von Hippel-Lindau disease. Surg Neurol Int 3: 6, 2012.
- Asthagiri AR, Mehta GU, Butman JA, et al.: Long-term stability after multilevel cervical laminectomy for spinal cord tumor resection in von Hippel-Lindau disease. J Neurosurg Spine 14 (4): 444-52, 2011.
- Das JM, Kesavapisharady K, Sadasivam S, et al.: Microsurgical Treatment of Sporadic and von Hippel-Lindau Disease Associated Spinal Hemangioblastomas: A Single-Institution Experience. Asian Spine J 11 (4): 548-555, 2017.
- Kano H, Shuto T, Iwai Y, et al.: Stereotactic radiosurgery for intracranial hemangioblastomas: a retrospective international outcome study. J Neurosurg 122 (6): 1469-78, 2015.
- Asthagiri AR, Mehta GU, Zach L, et al.: Prospective evaluation of radiosurgery for hemangioblastomas in von Hippel-Lindau disease. Neuro Oncol 12 (1): 80-6, 2010.
- Liebenow B, Tatter A, Dezarn WA, et al.: Gamma Knife Stereotactic Radiosurgery favorably changes the clinical course of hemangioblastoma growth in von Hippel-Lindau and sporadic patients. J Neurooncol 142 (3): 471-478, 2019.
- Tang JD, Grady AJ, Nickel CJ, et al.: Systematic Review of Endolymphatic Sac Tumor Treatment and Outcomes. Otolaryngol Head Neck Surg 168 (3): 282-290, 2023.
- Linehan WM, Pinto PA, Bratslavsky G, et al.: Hereditary kidney cancer: unique opportunity for disease-based therapy. Cancer 115 (10 Suppl): 2252-61, 2009.
- Shuch B: HIF2 Inhibition for von-Hippel Lindau Associated Kidney Cancer: Will Urology Lead or Follow? Urol Oncol 39 (5): 277-280, 2021.
- Jonasch E, McCutcheon IE, Waguespack SG, et al.: Pilot trial of sunitinib therapy in patients with von Hippel-Lindau disease. Ann Oncol 22 (12): 2661-6, 2011.
- Roma A, Maruzzo M, Basso U, et al.: First-Line sunitinib in patients with renal cell carcinoma (RCC) in von Hippel-Lindau (VHL) disease: clinical outcome and patterns of radiological response. Fam Cancer 14 (2): 309-16, 2015.
- Stamatakis L, Shuch B, Singer EA, et al.: Phase II trial of vandetanib in Von Hippel-Lindau-associated renal cell carcinoma. J Clin Oncol 31 (15 Suppl): 4584, 2013. Also available online. Last accessed October 22, 2024.
- Jonasch E, McCutcheon IE, Gombos DS, et al.: Pazopanib in patients with von Hippel-Lindau disease: a single-arm, single-centre, phase 2 trial. Lancet Oncol 19 (10): 1351-1359, 2018.
- Dahr SS, Cusick M, Rodriguez-Coleman H, et al.: Intravitreal anti-vascular endothelial growth factor therapy with pegaptanib for advanced von Hippel-Lindau disease of the retina. Retina 27 (2): 150-8, 2007.
- Kondo K, Kim WY, Lechpammer M, et al.: Inhibition of HIF2alpha is sufficient to suppress pVHL-defective tumor growth. PLoS Biol 1 (3): E83, 2003.
- Courtney KD, Infante JR, Lam ET, et al.: Phase I Dose-Escalation Trial of PT2385, a First-in-Class Hypoxia-Inducible Factor-2α Antagonist in Patients With Previously Treated Advanced Clear Cell Renal Cell Carcinoma. J Clin Oncol 36 (9): 867-874, 2018.
- Jonasch E, Donskov F, Iliopoulos O, et al.: Belzutifan for Renal Cell Carcinoma in von Hippel-Lindau Disease. N Engl J Med 385 (22): 2036-2046, 2021.
- Frantzen C, Kruizinga RC, van Asselt SJ, et al.: Pregnancy-related hemangioblastoma progression and complications in von Hippel-Lindau disease. Neurology 79 (8): 793-6, 2012.
- Ye DY, Bakhtian KD, Asthagiri AR, et al.: Effect of pregnancy on hemangioblastoma development and progression in von Hippel-Lindau disease. J Neurosurg 117 (5): 818-24, 2012.
Pronóstico
Tradicionalmente, la supervivencia de los pacientes con enfermedad de Von Hippel-Lindau (VHL) ha sido más precaria cuando se compara con la población general, debido a la morbilidad y mortalidad de las diversas manifestaciones de la enfermedad y el tratamiento correspondiente.[1] Es posible que los desenlaces estén mejorando gracias a la comprensión de la enfermedad y las estrategias modernas de tratamiento. En un estudio danés se comparó la esperanza de vida de personas con enfermedad de VHL y sus hermanos no afectados de ambos sexos; se observó una mediana de supervivencia de 67 años en hombres con enfermedad de VHL y de 60 años en mujeres con enfermedad de VHL.[2] En un segundo estudio de China, en el que participaron 340 pacientes con enfermedad de VHL, se estimó una mediana de esperanza de vida de 62 años.[3]
En el pasado, el carcinoma de células renales (RCC) metastásico produjo cerca de un tercio de las muertes en pacientes con enfermedad de VHL y, en algunos informes, fue la principal causa de muerte en los pacientes con enfermedad de VHL.[1,4,5,6] Se piensa que la tasa de mortalidad del RCC disminuirá significativamente al aumentar la vigilancia de las personas en quienes se confirma la presencia de una variante patogénica y al cumplir las recomendaciones de tratamiento del RCC que incluyen la norma de tamaño de 3 cm. En el estudio de China se observó que el 97 % de las muertes en pacientes con enfermedad de VHL se vincularon con la enfermedad; el hemangioblastoma de sistema nervioso central (SNC) y el RCC explicaron el 67,7 % y el 27,8 % de las muertes, respectivamente.[3] En el estudio danés se observó que el 79 % de las muertes se relacionaron con la enfermedad de VHL; el 51 % se atribuyó a hemangioblastoma del SCN, y el 36 %, al RCC.[2]
La morbilidad y la mortalidad de la enfermedad de VHL varían y cambian según el fenotipo individual y familiar de la enfermedad de VHL (por ejemplo, tipo 1, 2A, 2B o 2C). Para obtener más información, consultar la sección Correlaciones entre genotipo y fenotipo. En el estudio danés se notificó aumento del cociente de riesgos instantáneos de muerte en mujeres,[2] pero esto no se observó en las series de China.[3] La edad y el tipo de presentación a veces afectan el desenlace y quizás esto se explique por la agresividad de la enfermedad. El genotipo no tuvo un efecto en la probabilidad de supervivencia en la serie danesa, pero, en el estudio chino, aquellos con enfermedad de tipo 2 tuvieron una supervivencia más favorable en comparación con el tipo 1. Los pacientes con una variante de cambio de sentido tuvieron una supervivencia más favorable en comparación con quienes tenían una variante truncadora.
Referencias:
- Maher ER, Yates JR, Harries R, et al.: Clinical features and natural history of von Hippel-Lindau disease. Q J Med 77 (283): 1151-63, 1990.
- Binderup ML, Jensen AM, Budtz-Jørgensen E, et al.: Survival and causes of death in patients with von Hippel-Lindau disease. J Med Genet 54 (1): 11-18, 2017.
- Wang JY, Peng SH, Li T, et al.: Risk factors for survival in patients with von Hippel-Lindau disease. J Med Genet 55 (5): 322-328, 2018.
- Lamiell JM, Salazar FG, Hsia YE: von Hippel-Lindau disease affecting 43 members of a single kindred. Medicine (Baltimore) 68 (1): 1-29, 1989.
- Horton WA, Wong V, Eldridge R: Von Hippel-Lindau disease: clinical and pathological manifestations in nine families with 50 affected members. Arch Intern Med 136 (7): 769-77, 1976.
- Neumann HP: Basic criteria for clinical diagnosis and genetic counselling in von Hippel-Lindau syndrome. Vasa 16 (3): 220-6, 1987.
Indicaciones futuras
En la actualidad, las manifestaciones renales de la enfermedad de Von Hippel-Lindau (VHL) por lo general se tratan con un procedimiento quirúrgico o de ablación térmica. Está claro que es necesario mejorar las estrategias de atención y desarrollar un tratamiento sistémico dirigido. Esto incluirá precisar los aspectos moleculares y genéticos de la formación del cáncer de riñón, lo que puede conducir al desarrollo de estrategias para una prevención eficaz o tratamientos de intervención temprana. Además, el avance de la comprensión de las características moleculares de los cánceres de riñón establecidos puede brindar oportunidades para normalizar fenotípicamente el cáncer mediante la modulación de la función residual del gen VHL, la identificación de nuevas dianas terapéuticas y el descubrimiento de estrategias sintéticas letales que permitan erradicar de manera eficaz el carcinoma de células renales.
Actualizaciones más recientes a este resumen (01 / 10 / 2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Este resumen fue objeto de revisión integral.
El Consejo editorial del PDQ sobre la genética del cáncer es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre la genética de la enfermedad de Von Hippel-Lindau. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre la genética del cáncer, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Enfermedad de Von Hippel-Lindau son:
- Alexandra Perez Lebensohn, MS, CGC (National Cancer Institute)
- Brian Matthew Shuch, MD (UCLA Health)
- Ramaprasad Srinivasan, MD, PhD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre la genética del cáncer emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre la genética del cáncer. PDQ Enfermedad de Von Hippel-Lindau. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/rinon/pro/genetica-del-carcinoma-de-celulas-renales/enfermedad-de-vhl. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.
Última revisión: 2025-01-10

