Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Información general sobre el cáncer de vulva
Este resumen trata sobre el cáncer de células escamosas de vulva y las neoplasias intraepiteliales de vulva (VIN), algunas de las cuales se piensa que son precursoras de los cánceres de células escamosas invasivos.
Los labios mayores son el sitio más común del carcinoma de vulva y allí se presentan cerca del 50 % de los casos. Los casos de carcinoma de vulva en los labios menores representan entre el 15 % y el 20 %. El clítoris y las glándulas de Bartholino son los sitios que se afectan con menor frecuencia.[1] Las lesiones son multifocales en alrededor del 5 % de los casos. Más del 90 % de los casos de cáncer de vulva invasivos son carcinomas de células escamosas.[2]
Incidencia y mortalidad
El cáncer de vulva representa cerca del 6 % de todos los cánceres del aparato genital femenino en los Estados Unidos.[3]
Número estimado de casos nuevos y defunciones por cáncer de vulva en los Estados Unidos para 2024:[3]
- Casos nuevos: 6900.
- Defunciones: 1630.
Características anatómicas
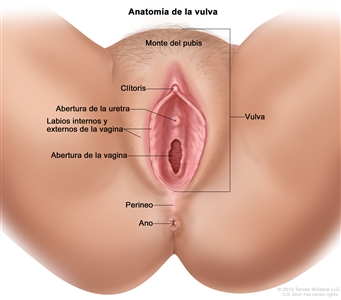
La vulva es el área directamente externa a la vagina, que incluye el monte del pubis o monte de Venus, los labios mayores y menores, el clítoris y las glándulas de Bartholino.
Factores de riesgo
La edad avanzada es el principal factor de riesgo para la mayoría de los cánceres. Otros factores de riesgo del cáncer de vulva son los siguientes:
- Infección por el virus del papiloma humano (VPH). En muchos casos, un condiloma o una displasia escamosa anteceden la formación del cáncer de vulva. La evidencia vigente apoya la idea de que la infección por el VPH es un factor causal de muchos carcinomas en el aparato genital.[4]
La VIN asociada con el VPH, denominada VIN de tipo común cuando es de grado 2 y 3, es más frecuente en mujeres menores de 50 años. Por el contrario, la VIN no asociada con el VPH, denominada VIN de tipo diferenciada cuando es de grado 3, es más frecuente en mujeres de más edad.[5,6]
El antiguo tipo de lesión VIN de grado 1 ya no se clasifica como VIN verdadera.[5,6] Las lesiones relacionadas con el VPH de tipo basaloide y de tipo condilomatoso se vinculan con la VIN. De 75 a 100 % de los carcinomas de tipo basaloide y de tipo condilomatoso albergan una infección por el VPH. Los subtipos basaloides y condilomatosos no solo tienen una prevalencia mucho más alta de infección por el VPH en comparación con los subtipos queratinizantes, además comparten muchos factores de riesgo con el cáncer de cuello uterino, entre ellos, los siguientes:
Para obtener más información, consultar Tratamiento del cáncer de cuello uterino.
Características clínicas
Es posible que las mujeres con VIN sean asintomáticas en el momento del diagnóstico.
Los signos y síntomas del cáncer de células escamosas de vulva son los siguientes:
- Lesión vulvar.
- Prurito vulvar.
- Hemorragia.
- Dolor.
Evaluación para el diagnóstico y la estadificación
Los siguientes procedimientos se utilizan para el diagnóstico y la estadificación del cáncer de vulva:
- Examen físico y antecedentes.
- Examen pélvico.
- Prueba de Papanicoláu.
- Prueba del virus del papiloma humano.
- Biopsia. En ocasiones, exploración física con anestesia.
- Colposcopia.
- Estudios por imágenes (imágenes por resonancia magnética, tomografía computarizada [TC], y tomografía por emisión de positrones con TC).
Pronóstico
El pronóstico depende del estado patológico de los ganglios linfáticos inguinales y de la diseminación a las estructuras adyacentes.[8] En las pacientes con una enfermedad operable sin compromiso ganglionar, la tasa de supervivencia general (SG) es del 90 %. Sin embargo, cuando hay compromiso ganglionar, la tasa de SG a 5 años oscila entre el 50 % y el 60 %.[9]
El tamaño del tumor primario es menos importante para determinar el pronóstico.[8]
Seguimiento después del tratamiento
Es posible que las neoplasias de vulva invasivas y preinvasivas se deban a una infección por el VPH, de manera que el efecto carcinógeno quizás abarque todo el epitelio vulvar. Por esto, las pacientes se vigilan de cerca para identificar signos o síntomas de recidiva.
Referencias:
- Macnab JC, Walkinshaw SA, Cordiner JW, et al.: Human papillomavirus in clinically and histologically normal tissue of patients with genital cancer. N Engl J Med 315 (17): 1052-8, 1986.
- Eifel PJ, Klopp AH, Berek JS, et al.: Cancer of the cervix, vagina, and vulva. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 1171-1210.
- American Cancer Society: Cancer Facts and Figures 2024. American Cancer Society, 2024. Available online. Last accessed June 21, 2024.
- Hampl M, Sarajuuri H, Wentzensen N, et al.: Effect of human papillomavirus vaccines on vulvar, vaginal, and anal intraepithelial lesions and vulvar cancer. Obstet Gynecol 108 (6): 1361-8, 2006.
- Pepas L, Kaushik S, Bryant A, et al.: Medical interventions for high grade vulval intraepithelial neoplasia. Cochrane Database Syst Rev (4): CD007924, 2011.
- Sideri M, Jones RW, Wilkinson EJ, et al.: Squamous vulvar intraepithelial neoplasia: 2004 modified terminology, ISSVD Vulvar Oncology Subcommittee. J Reprod Med 50 (11): 807-10, 2005.
- Schiffman M, Kjaer SK: Chapter 2: Natural history of anogenital human papillomavirus infection and neoplasia. J Natl Cancer Inst Monogr (31): 14-9, 2003.
- Olawaiye AB, Hagemann I, Bhoshale P, et al.: Vulva. In: Goodman KA, Gollub M, Eng C, et al.: AJCC Cancer Staging System. Version 9. American Joint Committee on Cancer; American College of Surgeons, 2023.
- Homesley HD, Bundy BN, Sedlis A, et al.: Assessment of current International Federation of Gynecology and Obstetrics staging of vulvar carcinoma relative to prognostic factors for survival (a Gynecologic Oncology Group study). Am J Obstet Gynecol 164 (4): 997-1003; discussion 1003-4, 1991.
Clasificación celular del cáncer de vulva
La International Society for the Study of Vulvovaginal Disease (ISSVD) formuló la clasificación histológica de la enfermedad vulvar y de las lesiones precursoras del cáncer de vulva.[1]
Trastornos epiteliales no neoplásicos de la piel y la mucosa vulvar
- Liquen escleroso (liquen escleroatrófico).
- Hiperplasia de células escamosas (antes, distrofia hiperplásica).
- Otras dermatosis.
Neoplasia intraepitelial de vulva (VIN)
- La lesión escamosa intraepitelial (SIL) de grado bajo de la vulva (LSIL vulvar) abarca el condiloma plano o el efecto del virus del papiloma humano.
- La SIL de grado alto (HSIL vulvar) se llamaba VIN de tipo común en la terminología del 2004 de la ISSVD.
- VIN de tipo diferenciada.
Enfermedad de Paget de la vulva
- Caracterizada por células grandes claras en el epitelio y los anejos cutáneos.
Otros tipos histológicos
- Carcinoma de células basales.
- Histiocitosis de células de Langerhans.
- Melanoma maligno.
- Sarcoma.
- Carcinoma verrugoso.
Referencias:
- Bornstein J, Bogliatto F, Haefner HK, et al.: The 2015 International Society for the Study of Vulvovaginal Disease (ISSVD) Terminology of Vulvar Squamous Intraepithelial Lesions. J Low Genit Tract Dis 20 (1): 11-4, 2016.
Información sobre los estadios del cáncer de vulva
La evaluación para la estadificación del cáncer de vulva quizás incluya las siguientes pruebas y procedimientos:
- Cistoscopia.
- Proctoscopia.
- Radiografías pulmonares.
- Urografía o pielografía intravenosa (IV).
La sospecha de compromiso vesical o rectal se debe confirmar mediante biopsia.[1]
Estadificación de la Fédération Internationale de Gynécologie et d'Obstétrique
La Fédération Internationale de Gynécologie et d'Obstétrique (FIGO) y el American Joint Committee on Cancer (AJCC) formularon la estadificación del cáncer de vulva; el sistema FIGO es el que más se usa.[1,2] El estadio se basa en la estadificación patológica en el momento de la cirugía, o antes de iniciar la radioterapia o la quimioterapia cuando éstas son las modalidades de tratamiento inicial.[3]
Este sistema de estadificación no se usa para el melanoma maligno de vulva, que se estadifica igual que el melanoma cutáneo.[1] Para obtener más información, consultar la sección Información sobre los estadios del melanoma en Tratamiento del melanoma.
| Estadio | Definición | |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d'Obstétrique. | ||
| a Adaptación de FIGO Committee on Gynecologic Oncology.[2] | ||
| b La profundidad de la invasión se mide desde la membrana basal de la cresta interpapilar adyacente más profunda displásica sin tumor (o la cresta interpapilar displásica más cercana) hasta el punto más profundo de invasión. | ||
| I | Tumor confinado en la vulva. | |
| IA | Tumor ≤2 cm con invasión estromal ≤1 mmb. | |
| IB | Tumor >2 cm o invasión estromal >1 mmb. | |
| Estadio | Definición |
|---|---|
| FIGO = Fédération Internationale de Gynécologie et d'Obstétrique. | |
| a Adaptación de FIGO Committee on Gynecologic Oncology.[2] | |
| II | Tumor de cualquier tamaño con extensión al tercio inferior de la uretra, el tercio inferior de la vagina o el tercio inferior del ano, sin compromiso ganglionar. |
| Estadio | Definición | |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d'Obstétrique. | ||
| a Adaptación de FIGO Committee on Gynecologic Oncology.[2] | ||
| b Regional indica los ganglios linfáticos inguinales o femorales. | ||
| III | Tumor de cualquier tamaño con extensión a la porción superior de las estructuras perineales adyacentes, o compromiso de ganglios linfáticos móviles sin ulceración. | |
| IIIA | Tumor de cualquier tamaño con extensión a los dos tercios superiores de la uretra, los dos tercios superiores de la vagina, la mucosa vesical, la mucosa rectal o metástasis ganglionares regionales ≤5 mm. | |
| IIIB | Metástasis ganglionares regionalesb>5 mm. | |
| IIIC | Metástasis ganglionares regionalesb con diseminación extracapsular. | |
| Estadio | Definición | |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d'Obstétrique. | ||
| a Adaptación de FIGO Committee on Gynecologic Oncology.[2] | ||
| b Regional indica los ganglios linfáticos inguinales o femorales. | ||
| IV | Tumor de cualquier tamaño con fijación al hueso, metástasis ganglionares fijas o ulceradas, o metástasis a distancia. | |
| IVA | Enfermedad con fijación al ilíacoo metástasis ganglionares regionales fijas o ulceradasb. | |
| IVB | Metástasis a distancia. | |
El grado se notifica a los sistemas de registro y a veces difiere entre sistemas porque se usan clasificaciones de 2, 3 y 4 grados. Si no se aclara, el sistema que más se usa es el siguiente:[1]
- GX: Grado no evaluable.
- G1: Bien diferenciado.
- G2: Moderadamente diferenciado
- G3: Pobremente diferenciado.
En general, alrededor del 30 % de las pacientes con enfermedad operable exhiben diseminación ganglionar. El tipo histológico afecta la distribución de la diseminación. Los factores de riesgo de metástasis ganglionares son los siguientes:[4,5,6,7,8]
- Estado ganglionar clínico.
- Edad.
- Grado de diferenciación tumoral.
- Estadio tumoral.
- Grosor tumoral.
- Profundidad de la invasión estromal.
- Invasión del espacio linfático capilar.
Las lesiones bien diferenciadas por lo general se diseminan por la superficie y producen poca invasión, mientras que las lesiones anaplásicas acarrean una mayor probabilidad de invasión profunda. La diseminación fuera de la vulva se produce a órganos adyacentes como la vagina, la uretra y el ano, o por medio del sistema linfático a los ganglios linfáticos inguinales o femorales, y luego a los ganglios pélvicos profundos. La diseminación hematógena es infrecuente.
Referencias:
- Olawaiye AB, Hagemann I, Bhoshale P, et al.: Vulva. In: Goodman KA, Gollub M, Eng C, et al.: AJCC Cancer Staging System. Version 9. American Joint Committee on Cancer; American College of Surgeons, 2023.
- Olawaiye AB, Cuello MA, Rogers LJ: Cancer of the vulva: 2021 update. Int J Gynaecol Obstet 155 (Suppl 1): 7-18, 2021.
- Hopkins MP, Reid GC, Johnston CM, et al.: A comparison of staging systems for squamous cell carcinoma of the vulva. Gynecol Oncol 47 (1): 34-7, 1992.
- Homesley HD, Bundy BN, Sedlis A, et al.: Assessment of current International Federation of Gynecology and Obstetrics staging of vulvar carcinoma relative to prognostic factors for survival (a Gynecologic Oncology Group study). Am J Obstet Gynecol 164 (4): 997-1003; discussion 1003-4, 1991.
- Boyce J, Fruchter RG, Kasambilides E, et al.: Prognostic factors in carcinoma of the vulva. Gynecol Oncol 20 (3): 364-77, 1985.
- Sedlis A, Homesley H, Bundy BN, et al.: Positive groin lymph nodes in superficial squamous cell vulvar cancer. A Gynecologic Oncology Group Study. Am J Obstet Gynecol 156 (5): 1159-64, 1987.
- Binder SW, Huang I, Fu YS, et al.: Risk factors for the development of lymph node metastasis in vulvar squamous cell carcinoma. Gynecol Oncol 37 (1): 9-16, 1990.
- Homesley HD, Bundy BN, Sedlis A, et al.: Prognostic factors for groin node metastasis in squamous cell carcinoma of the vulva (a Gynecologic Oncology Group study) Gynecol Oncol 49 (3): 279-83, 1993.
Aspectos generales de las opciones de tratamiento del cáncer de vulva
El tratamiento primario del cáncer de vulva es quirúrgico. Además, las pacientes con enfermedad en estadio III o IV reciben radioterapia.[1,2,3] Las estrategias más nuevas integran la cirugía, la radioterapia y la quimioterapia, y permiten adaptar el tratamiento según el compromiso clínico y patológico de la enfermedad. Las pautas para la combinación de estas estrategias terapéuticas varían.[4]
Hay poca información sobre la eficacia del tratamiento para las pacientes con enfermedad avanzada (estadios III y IV) porque estos casos son infrecuentes y no se ha definido un régimen de quimioterapia estándar para estas pacientes. En ocasiones, los médicos ofrecen la participación en ensayos clínicos a las pacientes con enfermedad en estadio III o IV.
Para obtener más información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
| Estadio ( criterios de estadificación de FIGO) | Opciones de tratamiento |
|---|---|
| FIGO = Fédération Internationale de Gynécologie et d'Obstétrique; VIN = neoplasia intraepitelial de la vulva. | |
| VIN (no se incluye en la estadificación de FIGO) | Cirugía |
| Imiquimod tópico | |
| Cáncer de vulva en estadios I y II | Cirugía |
| Cirugía y radioterapia | |
| Radioterapia sola | |
| Cáncer de vulva en estadio III | Cirugía con radioterapia o sin esta |
| Radioterapia o quimiorradioterapia seguida de cirugía | |
| Radioterapia con quimioterapia o sin esta | |
| Cáncer de vulva en estadio IVA | Cirugía |
| Cirugía y radioterapia | |
| Radioterapia o quimiorradioterapia seguida de cirugía | |
| Radioterapia con quimioterapia o sin esta | |
| Cáncer de vulva en estadio IVB | Quimioterapia |
| Cáncer de vulva recidivante | Extirpación local amplia con radioterapia o sin esta |
| Vulvectomía radical y exenteración pélvica | |
| Radioterapia y quimioterapia citotóxica sincrónicas, con cirugía o sin esta | |
Cirugía
Resección quirúrgica
Desde la década de 1980, la tendencia para la resección quirúrgica en las pacientes con cáncer de vulva es hacer una operación más limitada, que a menudo se combina con radioterapia a fin de reducir al mínimo la morbilidad.[5] Si durante el examen clínico se observa que los tumores están confinados en la vulva o el perineo, entonces se usa una extirpación local radical con un margen de por lo menos 1 cm en lugar de una vulvectomía radical, y se realiza una incisión separada en lugar de la disección ganglionar inguinal en bloque. En los tumores unilaterales, la disección ganglionar inguinal ipsilateral reemplazó la disección bilateral, y en muchos casos se omite la disección ganglionar femoral.[2,5,6,7] Sin embargo, las distintas técnicas quirúrgicas no se han sometido a una comparación directa en ensayos controlados aleatorizados. Además, en los estudios no aleatorizados no se usan definiciones uniformes para la estadificación ni descripciones exactas de la disección ganglionar o la radiación complementaria.[8][Niveles de evidencia C2 y C3] Por lo tanto el fundamento científico es escaso.
Disección de ganglio linfático centinela
Otra estrategia para reducir al mínimo la morbilidad de la disección ganglionar inguinal en las pacientes con enfermedad en estadio clínico temprano es la disección de ganglio linfático centinela (DGLC), de manera que solo se usa la disección inguinal cuando hay metástasis en uno o más ganglios linfáticos centinela.
Evidencia (disección de ganglio linfático centinela):
- En una serie de casos multicéntricos, 403 pacientes con cáncer de células escamosas primario de vulva de tamaño inferior a 4 cm y sin compromiso ganglionar inguinal se sometieron a 623 DGLC (con radiomarcador y tinción azul para la identificación del ganglio centinela).[9] Todas las pacientes se sometieron a resección radical del tumor primario. En el 26 % de los procedimientos de DGLC se identificaron metástasis ganglionares, posteriormente, estas pacientes se sometieron a una linfadenectomía inguinofemoral completa. Las pacientes sin compromiso de ganglios linfáticos centinela no recibieron otros tratamientos. El protocolo se modificó después de 2 casos de recidiva local entre 17 pacientes con tumores primarios multifocales, de manera que solo se permitió la participación de pacientes con tumores unifocales.[9][Nivel de evidencia C3]
- La morbilidad local fue mucho más baja en las pacientes que se sometieron a DGLC en comparación con las pacientes que tenían compromiso de ganglio centinela y que se sometieron a una linfadenectomía inguinofemoral (consultar el Cuadro 6).
Cuadro 6. Comparacióna de la morbilidad local en pacientes sometidas a disección de ganglio linfático centinela versus esta disección acompañada de linfadenectomía inguinofemoral Complicaciones Morbilidad local de la DGLC (%) Morbilidad local de la DGLC y la linfadenectomía inguinofemoral (%) DGLC = disección de ganglio linfático centinela. aP< 0,0001 para todas las comparaciones. Dehiscencia de la herida 11,7 34 Celulitis 4,5 21,3 Linfedema crónico 1,9 25,2 - La media de estadía hospitalaria fue de 8,4 días en las pacientes sometidas a DGLC y de 13,7 días en las pacientes sometidas a DGLC y linfadenectomía inguinofemoral (P < 0,0001).
- La tasa de recidiva inguinal actuarial a los 2 años en todas las pacientes sin compromiso de ganglio centinela fue del 3 % (intervalo de confianza [IC] 95 %, 1–6 %), y en las pacientes con tumores primarios unifocales fue de 2 % (IC 95 %, 1–5 %).
- La morbilidad local fue mucho más baja en las pacientes que se sometieron a DGLC en comparación con las pacientes que tenían compromiso de ganglio centinela y que se sometieron a una linfadenectomía inguinofemoral (consultar el Cuadro 6).
Por lo tanto, la DGLC quizás sea útil cuando la hace un cirujano experto en el procedimiento, de manera que a veces elimina la necesidad de una disección ganglionar inguinal completa o de radioterapia en pacientes con ganglios linfáticos clínicamente sanos.
Radioterapia
Es posible usar la radioterapia en las pacientes que no tolerarían la cirugía o cuando la cirugía se contraindica por el sitio o el grado de la enfermedad.[10,11,12,13]
Se encuentran metástasis ganglionares inguinales en el 20 % al 35 % de las pacientes con tumores confinados en la vulva sin compromiso ganglionar.[9,14] La disección ganglionar es un aspecto tradicional del tratamiento quirúrgico primario para la mayoría de los tumores excepto para los tumores más pequeños. Algunos investigadores recomiendan el uso de la radioterapia para evitar la morbilidad de la disección ganglionar, pero no queda claro si la radioterapia produce las mismas tasas de control local y supervivencia que se obtienen con la disección ganglionar en las pacientes con enfermedad en estadio temprano.
Enfermedad localizada sin compromiso ganglionar
Se notificó un ensayo aleatorizado en el que se estudió la eficacia de la radioterapia en pacientes con cáncer de vulva clínicamente localizado.[14,15] En ese estudio, las mujeres con enfermedad clínicamente confinada en la vulva, sin sospecha clínica de metástasis ganglionar inguinal, se sometieron a vulvectomía radical seguida de radiación inguinal (50 Gy en fracciones de 2 Gy) o disección inguinal (con radiación inguinal si había compromiso ganglionar patológico). Aunque se proyectó la inclusión de 300 pacientes, el estudio se interrumpió después de la asignación al azar de 58 mujeres porque se identificaron desenlaces más precarios en las mujeres del grupo de radioterapia.
- Se presentó recidiva inguinal en 5 de 27 (18,5 %) mujeres del grupo de radioterapia y en 0 de 25 mujeres del grupo de disección inguinal, pero esta diferencia no fue estadísticamente significativa (riesgo relativo [RR], 10,21; IC 95 %, 0,59–175,78).
- En el grupo de radioterapia murieron 10 mujeres y en el grupo de disección inguinal murieron 3 mujeres (RR, 4,31; IC 95 %, 1,03–18,15).
- La mortalidad específica de la enfermedad no fue estadísticamente diferente entre los dos grupos. Sin embargo, 8 mujeres murieron por complicaciones relacionadas con el cáncer de vulva en el grupo de radioterapia versus 2 mujeres en el grupo de disección inguinal (incluso una muerte relacionada con el procedimiento de disección inguinal) (RR, 3,70; IC 95 %, 0,87–15,80).[14,15][Nivel de evidencia A1]
- Se presentaron menos casos de linfedema (ningún caso en el grupo de radioterapia vs. 7 casos en el grupo de disección inguinal), y una estadía hospitalaria más corta en las pacientes del grupo de radioterapia. La penetración de la dosis de radiación (3 cm para la dosis completa) se consideró inadecuada.[14]
En resumen, el ensayo se interrumpió de manera prematura, y es poco lo que se puede concluir sobre la eficacia relativa de los dos abordajes de tratamiento.[14]
Enfermedad con compromiso ganglionar pélvico
El uso de radioterapia pélvica se comparó con la disección ganglionar pélvica en pacientes con compromiso ganglionar pélvico documentado.
Evidencia (resección ganglionar pélvica vs. radioterapia pélvica):
- Las pacientes con carcinoma de células escamosas primario de vulva en estadios clínicos I a IV, en quienes se encontraron metástasis ganglionares inguinales durante la vulvectomía radical con disección ganglionar bilateral, se asignaron al azar (durante el procedimiento quirúrgico) a un grupo de resección ganglionar ipsilateral y un grupo de radioterapia pélvica (45–50 Gy a 1,8–2,0 Gy por fracción).[16] La inscripción proyectada de 152 pacientes se interrumpió después de la aleatorización de 114 pacientes debido a que se percibió un beneficio emergente de la radioterapia. Sin embargo, el aparente beneficio de la radiación se atenuó después durante el seguimiento.[16][Nivel de evidencia A1]
- Tras una mediana de seguimiento de 74 meses, la tasa de supervivencia general (SG) a 6 años fue del 51 % en el grupo de radioterapia pélvica versus 41 % en el grupo de disección ganglionar pélvica (cociente de riesgos instantáneos [CRI], 0,61; IC 95 %, 0,3–1,3; P = 0,18).
- La mortalidad específica del cáncer de vulva fue inferior en el grupo de radioterapia pélvica, y la diferencia fue estadísticamente significativa (29 % en el grupo de radioterapia pélvica vs. el 51 % en el grupo de resección ganglionar pélvica) (CRI, 0,49; IC 95 %, 0,28–0,87; P = 0,015). No obstante, se presentaron 14 muertes intercurrentes en el grupo de radioterapia pélvica versus 2 muertes en el grupo de resección ganglionar pélvica.
- El linfedema crónico tardío fue similar en ambos grupos del ensayo, el 16 % en el grupo de radioterapia pélvica y el 22 % en el grupo de resección ganglionar pélvica.
Quimioterapia
No hay una quimioterapia estándar para el cáncer de vulva, y los informes que describen el uso de esta modalidad de tratamiento en el entorno de la enfermedad metastásica o recidivante son esporádicos.[5]
La quimioterapia se ha estudiado para usarla en combinación con la radioterapia en el entorno neoadyuvante o como tratamiento primario en la enfermedad avanzada a partir de la extrapolación de los regímenes que se usan para los cánceres de células escamosas de ano y cuello uterino. Los regímenes de quimioterapia incluyen varias combinaciones de fluorouracilo (5-FU), cisplatino, mitomicina o bleomicina.[5]
No hay evidencia clara de mejoría de la supervivencia o efectos paliativos. Debido a que muchas pacientes con cáncer de vulva avanzado o recidivante son de edad avanzada o tienen comorbilidades, la tolerabilidad farmacológica es un aspecto importante durante la administración de estos fármacos.
Tratamiento sistémico para las pacientes inoperables
No se encontraron ensayos aleatorizados en una revisión sistemática sobre el uso de quimiorradioterapia neoadyuvante en pacientes inoperables o que necesitaban una cirugía extensa, como exenteración pélvica, colostomía o derivación urinaria.[17] Se revisaron 5 estudios no aleatorizados que cumplieron con los criterios de inclusión sobre la administración de quimiorradioterapia neoadyuvante en esta población con el fin de intentar una cirugía curativa.[18,19,20,21,22] En los 5 estudios se usaron 4 programas diferentes de quimiorradioterapia y técnicas de fraccionamiento de las dosis de radioterapia. En los 4 estudios en los que se usó 5-FU con cisplatino o mitomicina, la tasa de operabilidad después de la quimiorradioterapia osciló entre el 63 % y el 92 %.[18,19,20,21] En un estudio que usó bleomicina, la tasa de operabilidad solo fue de 20 %.[22]
En resumen, la evidencia indica que la quimiorradioterapia prequirúrgica con 5-FU y cisplatino o mitomicina quizás aumente la operabilidad de las pacientes, pero el fundamento científico está limitado por el diseño del estudio. Además de la escasez de ensayos aleatorizados, la interpretación de estos estudios es complicada por la falta de una definición estándar de operabilidad.[4][Nivel de evidencia C3] La toxicidad del tratamiento es considerable.
Tratamiento sistémico para las pacientes operables
Hay poca evidencia sobre el uso de quimiorradioterapia neoadyuvante para el cáncer de vulva operable en estadio avanzado, y los datos disponibles no indican una ventaja de este abordaje. En una revisión sistemática solo se encontró un ensayo aleatorizado sobre este tema que se publicó como resumen.[4,23] En ese ensayo, se asignó al azar a 68 pacientes con cáncer de vulva avanzado (T2* >4 cm, T3*, cualquier caso con compromiso ganglionar) para recibir radioterapia neoadyuvante prequirúrgica (50 Gy) con 5-FU y mitomicina simultáneas, o someterse a cirugía primaria. La toxicidad grave relacionada con el tratamiento neoadyuvante fue alta (13 de 24 pacientes; 10 pacientes presentaron dehiscencia de la herida). Después de una media de seguimiento de 42 meses, la tasa de SG a 5 años fue del 30 % en el grupo de quimiorradioterapia neoadyuvante y del 49 % en el grupo de cirugía primaria (RRde muerte, 1,39; IC de 95 %, 0,94–2,06; P = 0,19).[4,23][Nivel de evidencia A1] *T2 se define como un tumor confinado en la vulva o el perineo, que mide más de 2 cm en su mayor dimensión, y T3 se define como un tumor con invasión de cualquiera de las siguientes partes: porción inferior de la uretra, vagina o ano.
Administración de fluorouracilo
El gen DPYD codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de DPYD que reducen la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo.[24,25] Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos.[24,25,26] Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD.[27,28,29] Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales.[30] Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.[31]
Referencias:
- Hacker NF, Van der Velden J: Conservative management of early vulvar cancer. Cancer 71 (4 Suppl): 1673-7, 1993.
- Thomas GM, Dembo AJ, Bryson SC, et al.: Changing concepts in the management of vulvar cancer. Gynecol Oncol 42 (1): 9-21, 1991.
- Homesley HD, Bundy BN, Sedlis A, et al.: Radiation therapy versus pelvic node resection for carcinoma of the vulva with positive groin nodes. Obstet Gynecol 68 (6): 733-40, 1986.
- Shylasree TS, Bryant A, Howells RE: Chemoradiation for advanced primary vulval cancer. Cochrane Database Syst Rev (4): CD003752, 2011.
- Eifel PJ, Klopp AH, Berek JS, et al.: Cancer of the cervix, vagina, and vulva. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 1171-1210.
- Hoffman MS, Roberts WS, Lapolla JP, et al.: Recent modifications in the treatment of invasive squamous cell carcinoma of the vulva. Obstet Gynecol Surv 44 (4): 227-33, 1989.
- Heaps JM, Fu YS, Montz FJ, et al.: Surgical-pathologic variables predictive of local recurrence in squamous cell carcinoma of the vulva. Gynecol Oncol 38 (3): 309-14, 1990.
- Ansink A, van der Velden J: Surgical interventions for early squamous cell carcinoma of the vulva. Cochrane Database Syst Rev (2): CD002036, 2000.
- Van der Zee AG, Oonk MH, De Hullu JA, et al.: Sentinel node dissection is safe in the treatment of early-stage vulvar cancer. J Clin Oncol 26 (6): 884-9, 2008.
- Petereit DG, Mehta MP, Buchler DA, et al.: Inguinofemoral radiation of N0,N1 vulvar cancer may be equivalent to lymphadenectomy if proper radiation technique is used. Int J Radiat Oncol Biol Phys 27 (4): 963-7, 1993.
- Slevin NJ, Pointon RC: Radical radiotherapy for carcinoma of the vulva. Br J Radiol 62 (734): 145-7, 1989.
- Perez CA, Grigsby PW, Galakatos A, et al.: Radiation therapy in management of carcinoma of the vulva with emphasis on conservation therapy. Cancer 71 (11): 3707-16, 1993.
- Kumar PP, Good RR, Scott JC: Techniques for management of vulvar cancer by irradiation alone. Radiat Med 6 (4): 185-91, 1988 Jul-Aug.
- Stehman FB, Bundy BN, Thomas G, et al.: Groin dissection versus groin radiation in carcinoma of the vulva: a Gynecologic Oncology Group study. Int J Radiat Oncol Biol Phys 24 (2): 389-96, 1992.
- van der Velden J, Fons G, Lawrie TA: Primary groin irradiation versus primary groin surgery for early vulvar cancer. Cochrane Database Syst Rev (5): CD002224, 2011.
- Kunos C, Simpkins F, Gibbons H, et al.: Radiation therapy compared with pelvic node resection for node-positive vulvar cancer: a randomized controlled trial. Obstet Gynecol 114 (3): 537-46, 2009.
- van Doorn HC, Ansink A, Verhaar-Langereis M, et al.: Neoadjuvant chemoradiation for advanced primary vulvar cancer. Cochrane Database Syst Rev 3: CD003752, 2006.
- Eifel PJ, Morris M, Burke TW, et al.: Prolonged continuous infusion cisplatin and 5-fluorouracil with radiation for locally advanced carcinoma of the vulva. Gynecol Oncol 59 (1): 51-6, 1995.
- Landoni F, Maneo A, Zanetta G, et al.: Concurrent preoperative chemotherapy with 5-fluorouracil and mitomycin C and radiotherapy (FUMIR) followed by limited surgery in locally advanced and recurrent vulvar carcinoma. Gynecol Oncol 61 (3): 321-7, 1996.
- Montana GS, Thomas GM, Moore DH, et al.: Preoperative chemo-radiation for carcinoma of the vulva with N2/N3 nodes: a gynecologic oncology group study. Int J Radiat Oncol Biol Phys 48 (4): 1007-13, 2000.
- Moore DH, Thomas GM, Montana GS, et al.: Preoperative chemoradiation for advanced vulvar cancer: a phase II study of the Gynecologic Oncology Group. Int J Radiat Oncol Biol Phys 42 (1): 79-85, 1998.
- Scheiströen M, Tropé C: Combined bleomycin and irradiation in preoperative treatment of advanced squamous cell carcinoma of the vulva. Acta Oncol 32 (6): 657-61, 1993.
- Maneo A, Landoni F, Colombo A, et al.: Randomised study between neoadjuvant chemoradiotherapy and primary surgery for the treatment of advanced vulvar cancer. [Abstract] Int J Gynecol Cancer 13 (Suppl 1): A-PL19, 6, 2003.
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021.
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016.
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021.
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018.
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018.
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022.
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022.
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023.
Tratamiento de la neoplasia intraepitelial de vulva
Opciones de tratamiento de la neoplasia intraepitelial de vulva
Las opciones de tratamiento de la neoplasia intraepitelial de vulva son las siguientes:
- Cirugía.
- Extirpación independiente de las lesiones focales.[1]
- Extirpación local amplia.[1]
- Cirugía con láser de dióxido de carbono (CO2) y vaporización.[2,3] Una desventaja de la vaporización es que no se obtiene tejido para el examen histológico a fin de confirmar la extirpación completa de la lesión y la ausencia de enfermedad invasiva.
- Aspiración quirúrgica ultrasónica.[2,3]
- Vulvectomía cutánea superficial (tegumentaria) con injerto o sin este.[1]
- Imiquimod tópico para las pacientes que quieren evitar la cirugía.[4,5,6,7,8]
Tradicionalmente se han usado tres grados de VIN; sin embargo, no se ha comprobado que los tres grados correspondan al mismo proceso biológico continuo o de que el grado 1 sea una lesión precancerosa. En 2004, la International Society for the Study of Vulvar Disease (ISSVD) modificó la terminología, y reservó la designación de VIN para dos categorías de lesiones a partir del aspecto morfológico.[9] En 2015, la ISSVD formuló nueva terminología para las lesiones escamosas intraepiteliales (SIL) de la vulva, de la siguiente manera:[10]
- La SIL de grado bajo de la vulva (LSIL vulvar) abarca el condiloma plano o el efecto del virus del papiloma humano.
- La SIL de grado alto (HSIL vulvar) se llamaba VIN de tipo común en la terminología del 2004 de la ISSVD.
- VIN de tipo diferenciada.
El tratamiento de la VIN de grado alto a menudo es una terapia activa debido a un riesgo más alto de progresión a enfermedad invasiva.[2] Las tasas de progresión estimadas son imprecisas. En una revisión sistemática de la bibliografía médica que incluyó a 88 pacientes con VIN 3 no tratadas, se notificó una tasa de progresión de 9 % (8 de 88 pacientes) a cáncer de vulva invasivo durante 12 a 96 meses de observación. En la misma revisión, la tasa de regresión espontánea fue del 1,2 %, y todos los casos se presentaron en mujeres menores de 35 años.[1] Sin embargo, en un estudio de un solo centro, 10 de 63 (16 %) mujeres con VIN 2 o VIN 3 no tratadas exhibieron progresión a cáncer invasivo después de una media de 3,9 años.[11]
Las lesiones de las VIN son multifocales o confluentes y extensas. Es importante obtener múltiples biopsias para planificar el tratamiento y excluir una enfermedad invasiva oculta. La VIN en áreas no pilosas se considera una enfermedad epitelial; sin embargo, la VIN en sitios pilosos afecta al aparato pilosebáceo y requiere una extirpación más profunda porque se puede diseminar por las raíces del pelo.
Cirugía
El abordaje terapéutico principal es quirúrgico, pero no hay acuerdo sobre el procedimiento quirúrgico ideal. El objetivo de la cirugía es extirpar o destruir la lesión VIN completa y preservar las características anatómicas y funcionales de la vulva. Una vulvectomía simple produce una tasa de supervivencia a 5 años de casi el 100 %; sin embargo, pocas veces está indicada. Otros procedimientos quirúrgicos más limitados, como la extirpación independiente de múltiples lesiones causan menos deformidad.[12] La elección del tratamiento depende de la extensión de la enfermedad y la experiencia del médico. No hay datos de comparación confiables sobre la eficacia y la inocuidad de los diferentes abordajes quirúrgicos.
En una revisión sistemática de la bibliografía se identificó solo un ensayo aleatorizado de comparación de abordajes quirúrgicos.[2] En ese ensayo, 30 mujeres con VIN de grado alto fueron asignadas al azar a recibir ablación con láser de CO2 o aspiración quirúrgica ultrasónica.[3] No se presentaron diferencias estadísticamente significativas en la recidiva de la enfermedad, disuria o micción urente, adherencias o cicatrización en el periodo entre 2 tratamientos, después de 1 año de seguimiento. Se observó cicatrización en 5 de 16 mujeres tratadas con ablación por láser, y 0 de 14 mujeres tratadas con aspiración quirúrgica ultrasónica (P < 0,01), pero no se notificaron las consecuencias de la cicatrización en el funcionamiento sexual o la calidad de vida.[3][Nivel de evidencia B1] El ensayo clínico fue muy pequeño como para permitir conclusiones confiables sobre la eficacia relativa de estas técnicas quirúrgicas. El resto de la bibliografía sobre la cirugía se deriva de series de casos y es proclive a sesgos importantes.[Nivel de evidencia C2]
Sin importar el procedimiento que se use, todas las pacientes exhiben un riesgo alto de recidiva, en especial, cuando las lesiones son de grado alto o multifocales.[13] Los sitios de recidiva más frecuentes son la piel perianal, el área presacra y el prepucio del clítoris. Cerca del 4 % de las pacientes tratadas por una VIN luego presentan un cáncer invasivo.[14,15]
Intervenciones no quirúrgicas
Imiquimod tópico
En las mujeres con VIN de grado alto, se notificaron tasas de respuesta importantes y tolerabilidad aceptable con el uso tópico de imiquimod al 5 %, un modificador de la respuesta inmunitaria con actividad contra los condilomas de vulva relacionados con el VPH 6 y el VPH 11.
Evidencia (imiquimod):
- En revistas con revisión externa o en formato de resumen se notificaron 3 ensayos aleatorizados controlados con placebo (104 pacientes en total) en los que se evaluó la respuesta clínica como criterio principal de valoración.[7];[4,5,6][Nivel de evidencia B3] Los resultados de estos ensayos se resumen en una revisión sistemática.[8]
- Entre los 5 y 6 meses, las tasas de respuesta completa fueron de 36 entre 62 pacientes en el grupo de imiquimod combinado versus 0 entre 42 pacientes en el grupo de placebo combinado, y las tasas de respuesta parcial fueron de 18 entre 62 pacientes en el grupo de imiquimod combinado versus 1 entre 42 en el grupo de placebo combinado (riesgo relativo, 11,95; intervalo de confianza 95 %, 3,21–44,51).
- No hubo diferencia en la tasa de progresión en el único ensayo en el que se notificó progresión al cáncer a los 12 meses, pero la potencia del ensayo fue demasiado baja porque sólo 3 de las 52 participantes presentaron enfermedad invasiva a los 12 meses.[6]
- En el único ensayo en el que se notificaron resultados de calidad de vida,[6] no se observaron diferencias entre el imiquimod y el placebo.
- Los efectos secundarios locales del imiquimod fueron dolor, edema, eritema y un caso único de excoriación. Sin embargo, ningún paciente tuvo que interrumpir el tratamiento debido a toxicidad.
Otras intervenciones no quirúrgicas
Los abordajes no quirúrgicos se han estudiado porque los procedimientos quirúrgicos en la vulva producen morbilidad física y psicosexual. Algunos de estos abordajes, como el fluorouracilo tópico, el interferón gamma recombinante, la bleomicina y el trinitroclorobenceno, ya no se usan por las tasa altas de recidiva o por los efectos secundarios locales intolerables, como dolor, irritación y ulceración.[8,16]
También se ha empleado la terapia fotodinámica con aplicación tópica de ácido 5-aminolevulínico como sensibilizador para una luz láser de 635 nm. Sin embargo, los datos se limitan a series de casos pequeñas con tasas de respuesta variables.[17,18][Nivel de evidencia C3]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Referencias:
- van Seters M, van Beurden M, de Craen AJ: Is the assumed natural history of vulvar intraepithelial neoplasia III based on enough evidence? A systematic review of 3322 published patients. Gynecol Oncol 97 (2): 645-51, 2005.
- Kaushik S, Pepas L, Nordin A, et al.: Surgical interventions for high grade vulval intraepithelial neoplasia. Cochrane Database Syst Rev (1): CD007928, 2011.
- von Gruenigen VE, Gibbons HE, Gibbins K, et al.: Surgical treatments for vulvar and vaginal dysplasia: a randomized controlled trial. Obstet Gynecol 109 (4): 942-7, 2007.
- Sterling JC, Smith NA, Loo WJ, et al.: Randomized, doubleblind, placebo-controlled trial for treatment of high grade vulval intraepithelial neoplasia with imiquimod. [Abstract] J Eur Acad Derm Venereol 19 (Suppl 2): A-FC06.1, 22, 2005.
- Mathiesen O, Buus SK, Cramers M: Topical imiquimod can reverse vulvar intraepithelial neoplasia: a randomised, double-blinded study. Gynecol Oncol 107 (2): 219-22, 2007.
- van Seters M, van Beurden M, ten Kate FJ, et al.: Treatment of vulvar intraepithelial neoplasia with topical imiquimod. N Engl J Med 358 (14): 1465-73, 2008.
- Terlou A, van Seters M, Ewing PC, et al.: Treatment of vulvar intraepithelial neoplasia with topical imiquimod: seven years median follow-up of a randomized clinical trial. Gynecol Oncol 121 (1): 157-62, 2011.
- Pepas L, Kaushik S, Bryant A, et al.: Medical interventions for high grade vulval intraepithelial neoplasia. Cochrane Database Syst Rev (4): CD007924, 2011.
- Sideri M, Jones RW, Wilkinson EJ, et al.: Squamous vulvar intraepithelial neoplasia: 2004 modified terminology, ISSVD Vulvar Oncology Subcommittee. J Reprod Med 50 (11): 807-10, 2005.
- Bornstein J, Bogliatto F, Haefner HK, et al.: The 2015 International Society for the Study of Vulvovaginal Disease (ISSVD) Terminology of Vulvar Squamous Intraepithelial Lesions. J Low Genit Tract Dis 20 (1): 11-4, 2016.
- Jones RW, Rowan DM, Stewart AW: Vulvar intraepithelial neoplasia: aspects of the natural history and outcome in 405 women. Obstet Gynecol 106 (6): 1319-26, 2005.
- Eifel PJ, Klopp AH, Berek JS, et al.: Cancer of the cervix, vagina, and vulva. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 1171-1210.
- Küppers V, Stiller M, Somville T, et al.: Risk factors for recurrent VIN. Role of multifocality and grade of disease. J Reprod Med 42 (3): 140-4, 1997.
- Buscema J, Woodruff JD, Parmley TH, et al.: Carcinoma in situ of the vulva. Obstet Gynecol 55 (2): 225-30, 1980.
- Jones RW, Rowan DM: Vulvar intraepithelial neoplasia III: a clinical study of the outcome in 113 cases with relation to the later development of invasive vulvar carcinoma. Obstet Gynecol 84 (5): 741-5, 1994.
- Sillman FH, Sedlis A, Boyce JG: A review of lower genital intraepithelial neoplasia and the use of topical 5-fluorouracil. Obstet Gynecol Surv 40 (4): 190-220, 1985.
- Hillemanns P, Untch M, Dannecker C, et al.: Photodynamic therapy of vulvar intraepithelial neoplasia using 5-aminolevulinic acid. Int J Cancer 85 (5): 649-53, 2000.
- Fehr MK, Hornung R, Schwarz VA, et al.: Photodynamic therapy of vulvar intraepithelial neoplasia III using topically applied 5-aminolevulinic acid. Gynecol Oncol 80 (1): 62-6, 2001.
Tratamiento del cáncer de vulva en estadios I y II
Opciones de tratamiento del cáncer de vulva en estadios I y II
Las opciones de tratamiento del cáncer de vulva en estadio I y estadio II son las siguientes:
- Cirugía.
- Cirugía y radioterapia.
- Radioterapia sola.
Cirugía
Extirpación local radical con disección ganglionar inguinal y femoral ipsilateral o bilateral. Para las lesiones en estadio I con microinvasión (<1 mm de invasión) sin distrofia vulvar grave asociada, es posible hacer una extirpación amplia (margen de 1 cm, sin disección de ganglios linfáticos). Es posible hacer una extirpación radical local con linfadenectomía unilateral completa para el resto de las lesiones en estadio I, siempre y cuando sean laterales, sin distrofia difusa grave ni compromiso ganglionar.[1] Las pacientes aptas para este procedimiento deben tener lesiones que midan 2 cm o menos de diámetro y 5 mm o menos de invasión, sin invasión del espacio linfático capilar ni compromiso clínico ganglionar.[2,3]
En las pacientes con enfermedad en estadio II, es posible que los tumores grandes T2* exijan una vulvectomía radical modificada o una vulvectomía radical.[4]*T2 se define como un tumor confinado en la vulva o el perineo, que mide más de 2 cm en su mayor dimensión.
Para la enfermedad en estadio I y estadio II, se indica la extirpación local radical y la disección de ganglio centinela, mientras que la disección inguinal se reserva para las pacientes con metástasis en uno o más ganglios centinelas.[5]
Cirugía y radioterapia
Algunos investigadores recomiendan la extirpación radical y la radioterapia ganglionar inguinal como una manera de evitar la morbilidad de la disección ganglionar. No queda claro si la radioterapia produce las mismas tasas de control local y supervivencia que se obtienen con la disección ganglionar en las pacientes con enfermedad en estadio temprano. Un ensayo aleatorizado que abordó este problema en pacientes con enfermedad vulvar clínicamente localizada se interrumpió de manera prematura porque se identificaron desenlaces más precarios en las mujeres del grupo de radioterapia.[6,7] Para la enfermedad en estadio II, la radioterapia adyuvante local quizás esté indicada cuando se obtienen márgenes quirúrgicos de menos de 8 mm, hay invasión del espacio linfático capilar y el grosor es superior a 5 mm.[8,9]
Radioterapia sola
Es posible que la radioterapia radical produzca una supervivencia favorable en las pacientes incapaces de tolerar una cirugía radical o que no reúnen los requisitos para someterse a cirugía debido al sitio o la extensión de la enfermedad.[10,11,12,13]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Referencias:
- Malfetano JH, Piver MS, Tsukada Y, et al.: Univariate and multivariate analyses of 5-year survival, recurrence, and inguinal node metastases in stage I and II vulvar carcinoma. J Surg Oncol 30 (2): 124-31, 1985.
- Stehman FB, Bundy BN, Dvoretsky PM, et al.: Early stage I carcinoma of the vulva treated with ipsilateral superficial inguinal lymphadenectomy and modified radical hemivulvectomy: a prospective study of the Gynecologic Oncology Group. Obstet Gynecol 79 (4): 490-7, 1992.
- Hacker NF, Van der Velden J: Conservative management of early vulvar cancer. Cancer 71 (4 Suppl): 1673-7, 1993.
- Eifel PJ, Klopp AH, Berek JS, et al.: Cancer of the cervix, vagina, and vulva. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 1171-1210.
- Van der Zee AG, Oonk MH, De Hullu JA, et al.: Sentinel node dissection is safe in the treatment of early-stage vulvar cancer. J Clin Oncol 26 (6): 884-9, 2008.
- Stehman FB, Bundy BN, Thomas G, et al.: Groin dissection versus groin radiation in carcinoma of the vulva: a Gynecologic Oncology Group study. Int J Radiat Oncol Biol Phys 24 (2): 389-96, 1992.
- van der Velden J, Fons G, Lawrie TA: Primary groin irradiation versus primary groin surgery for early vulvar cancer. Cochrane Database Syst Rev (5): CD002224, 2011.
- Thomas GM, Dembo AJ, Bryson SC, et al.: Changing concepts in the management of vulvar cancer. Gynecol Oncol 42 (1): 9-21, 1991.
- Faul CM, Mirmow D, Huang Q, et al.: Adjuvant radiation for vulvar carcinoma: improved local control. Int J Radiat Oncol Biol Phys 38 (2): 381-9, 1997.
- Petereit DG, Mehta MP, Buchler DA, et al.: Inguinofemoral radiation of N0,N1 vulvar cancer may be equivalent to lymphadenectomy if proper radiation technique is used. Int J Radiat Oncol Biol Phys 27 (4): 963-7, 1993.
- Slevin NJ, Pointon RC: Radical radiotherapy for carcinoma of the vulva. Br J Radiol 62 (734): 145-7, 1989.
- Perez CA, Grigsby PW, Galakatos A, et al.: Radiation therapy in management of carcinoma of the vulva with emphasis on conservation therapy. Cancer 71 (11): 3707-16, 1993.
- Kumar PP, Good RR, Scott JC: Techniques for management of vulvar cancer by irradiation alone. Radiat Med 6 (4): 185-91, 1988 Jul-Aug.
Tratamiento del cáncer de vulva en estadio III
Opciones de tratamiento del cáncer de vulva en estadio III
Las opciones de tratamiento del cáncer de vulva en estadio III son las siguientes:
- Cirugía con radioterapia o sin esta.
- Radioterapia o quimiorradioterapia seguida de cirugía.
- Radioterapia con quimioterapia o sin esta.
Cirugía con radioterapia o sin esta
El tratamiento estándar es vulvectomía radical modificada o vulvectomía radical con linfadenectomía inguinal y femoral.[1] El compromiso ganglionar es un determinante central para la supervivencia. La radioterapia se administra a las pacientes con lesiones primarias grandes y márgenes estrechos. La radioterapia se dirige a la pelvis y la ingle si hay compromiso ganglionar.[2] Por lo general, se administra radioterapia dirigida a la pelvis y la ingle si hay compromiso de dos o más ganglios linfáticos inguinales.[2,3]
A veces también se indica el uso de radioterapia adyuvante localizada en dosis de 45 a 50 Gy cuando hay invasión del espacio linfático capilar y un grosor superior a 5 mm, en especial, si hay compromiso ganglionar.[1]
Radioterapia o quimiorradioterapia seguida de cirugía
Es posible usar radioterapia neoadyuvante preoperatoria o quimiorradioterapia para mejorar la operabilidad e incluso disminuir la extensión de la cirugía.[4,5,6,7,8,9,10]
Radioterapia con quimioterapia o sin esta
Es posible que la radioterapia radical produzca una supervivencia prolongada en las pacientes que no pueden tolerar una cirugía radical o que no reúnen los requisitos para someterse a cirugía debido al sitio o la extensión de la enfermedad.[11,12] Algunos médicos prefieren añadir de manera simultánea fluorouracilo (5-FU), o 5-FU y cisplatino.[1,13]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Referencias:
- Thomas GM, Dembo AJ, Bryson SC, et al.: Changing concepts in the management of vulvar cancer. Gynecol Oncol 42 (1): 9-21, 1991.
- Kunos C, Simpkins F, Gibbons H, et al.: Radiation therapy compared with pelvic node resection for node-positive vulvar cancer: a randomized controlled trial. Obstet Gynecol 114 (3): 537-46, 2009.
- Homesley HD, Bundy BN, Sedlis A, et al.: Prognostic factors for groin node metastasis in squamous cell carcinoma of the vulva (a Gynecologic Oncology Group study) Gynecol Oncol 49 (3): 279-83, 1993.
- Boronow RC, Hickman BT, Reagan MT, et al.: Combined therapy as an alternative to exenteration for locally advanced vulvovaginal cancer. II. Results, complications, and dosimetric and surgical considerations. Am J Clin Oncol 10 (2): 171-81, 1987.
- Anderson JM, Cassady JR, Shimm DS, et al.: Vulvar carcinoma. Int J Radiat Oncol Biol Phys 32 (5): 1351-7, 1995.
- van Doorn HC, Ansink A, Verhaar-Langereis M, et al.: Neoadjuvant chemoradiation for advanced primary vulvar cancer. Cochrane Database Syst Rev 3: CD003752, 2006.
- Eifel PJ, Morris M, Burke TW, et al.: Prolonged continuous infusion cisplatin and 5-fluorouracil with radiation for locally advanced carcinoma of the vulva. Gynecol Oncol 59 (1): 51-6, 1995.
- Landoni F, Maneo A, Zanetta G, et al.: Concurrent preoperative chemotherapy with 5-fluorouracil and mitomycin C and radiotherapy (FUMIR) followed by limited surgery in locally advanced and recurrent vulvar carcinoma. Gynecol Oncol 61 (3): 321-7, 1996.
- Montana GS, Thomas GM, Moore DH, et al.: Preoperative chemo-radiation for carcinoma of the vulva with N2/N3 nodes: a gynecologic oncology group study. Int J Radiat Oncol Biol Phys 48 (4): 1007-13, 2000.
- Moore DH, Thomas GM, Montana GS, et al.: Preoperative chemoradiation for advanced vulvar cancer: a phase II study of the Gynecologic Oncology Group. Int J Radiat Oncol Biol Phys 42 (1): 79-85, 1998.
- Perez CA, Grigsby PW, Galakatos A, et al.: Radiation therapy in management of carcinoma of the vulva with emphasis on conservation therapy. Cancer 71 (11): 3707-16, 1993.
- Slevin NJ, Pointon RC: Radical radiotherapy for carcinoma of the vulva. Br J Radiol 62 (734): 145-7, 1989.
- Eifel PJ, Klopp AH, Berek JS, et al.: Cancer of the cervix, vagina, and vulva. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 1171-1210.
Tratamiento del cáncer de vulva en estadio IVA
Opciones de tratamiento del cáncer de vulva en estadio IVA
Las opciones de tratamiento del cáncer de vulva en estadio IVA son las siguientes:
- Cirugía.
- Cirugía y radioterapia.
- Radioterapia o quimiorradioterapia seguida de cirugía.
- Radioterapia con quimioterapia o sin esta.
Cirugía
Es posible que el tratamiento indicado para las pacientes con cáncer de vulva en estadio IVA sea vulvectomía radical y exenteración pélvica.
Cirugía y radioterapia
A veces se usa cirugía seguida de radioterapia después de la resección de lesiones grandes con márgenes estrechos. También se indica el uso de radioterapia adyuvante localizada en dosis de 45 a 50 Gy cuando hay invasión del espacio linfático capilar y un grosor superior a 5 mm.[1] Se administra radioterapia dirigida a la pelvis y la ingle si hay compromiso de uno o más ganglios linfáticos inguinales.[2,3]
Radioterapia o quimiorradioterapia seguida de cirugía
A veces se administra radioterapia neoadyuvante o quimiorradioterapia para lesiones primarias grandes (a fin de mejorar la operabilidad) seguida de cirugía radical.[4,5,6,7,8,9,10]
Radioterapia con quimioterapia o sin esta
Es posible que la radioterapia radical produzca una supervivencia prolongada en las pacientes que no pueden tolerar una vulvectomía radical o que no se consideran aptas para someterse a cirugía debido al sitio o la extensión de la enfermedad.[11,12] Cuando se usa radioterapia como tratamiento primario definitivo del cáncer de vulva, algunos médicos prefieren añadir de manera simultánea fluorouracilo (5-FU), o 5-FU y cisplatino.[1,13,14,15,16,17]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Referencias:
- Thomas GM, Dembo AJ, Bryson SC, et al.: Changing concepts in the management of vulvar cancer. Gynecol Oncol 42 (1): 9-21, 1991.
- Homesley HD, Bundy BN, Sedlis A, et al.: Radiation therapy versus pelvic node resection for carcinoma of the vulva with positive groin nodes. Obstet Gynecol 68 (6): 733-40, 1986.
- Kunos C, Simpkins F, Gibbons H, et al.: Radiation therapy compared with pelvic node resection for node-positive vulvar cancer: a randomized controlled trial. Obstet Gynecol 114 (3): 537-46, 2009.
- Boronow RC, Hickman BT, Reagan MT, et al.: Combined therapy as an alternative to exenteration for locally advanced vulvovaginal cancer. II. Results, complications, and dosimetric and surgical considerations. Am J Clin Oncol 10 (2): 171-81, 1987.
- Anderson JM, Cassady JR, Shimm DS, et al.: Vulvar carcinoma. Int J Radiat Oncol Biol Phys 32 (5): 1351-7, 1995.
- van Doorn HC, Ansink A, Verhaar-Langereis M, et al.: Neoadjuvant chemoradiation for advanced primary vulvar cancer. Cochrane Database Syst Rev 3: CD003752, 2006.
- Eifel PJ, Morris M, Burke TW, et al.: Prolonged continuous infusion cisplatin and 5-fluorouracil with radiation for locally advanced carcinoma of the vulva. Gynecol Oncol 59 (1): 51-6, 1995.
- Landoni F, Maneo A, Zanetta G, et al.: Concurrent preoperative chemotherapy with 5-fluorouracil and mitomycin C and radiotherapy (FUMIR) followed by limited surgery in locally advanced and recurrent vulvar carcinoma. Gynecol Oncol 61 (3): 321-7, 1996.
- Montana GS, Thomas GM, Moore DH, et al.: Preoperative chemo-radiation for carcinoma of the vulva with N2/N3 nodes: a gynecologic oncology group study. Int J Radiat Oncol Biol Phys 48 (4): 1007-13, 2000.
- Moore DH, Thomas GM, Montana GS, et al.: Preoperative chemoradiation for advanced vulvar cancer: a phase II study of the Gynecologic Oncology Group. Int J Radiat Oncol Biol Phys 42 (1): 79-85, 1998.
- Slevin NJ, Pointon RC: Radical radiotherapy for carcinoma of the vulva. Br J Radiol 62 (734): 145-7, 1989.
- Perez CA, Grigsby PW, Galakatos A, et al.: Radiation therapy in management of carcinoma of the vulva with emphasis on conservation therapy. Cancer 71 (11): 3707-16, 1993.
- Russell AH, Mesic JB, Scudder SA, et al.: Synchronous radiation and cytotoxic chemotherapy for locally advanced or recurrent squamous cancer of the vulva. Gynecol Oncol 47 (1): 14-20, 1992.
- Berek JS, Heaps JM, Fu YS, et al.: Concurrent cisplatin and 5-fluorouracil chemotherapy and radiation therapy for advanced-stage squamous carcinoma of the vulva. Gynecol Oncol 42 (3): 197-201, 1991.
- Koh WJ, Wallace HJ, Greer BE, et al.: Combined radiotherapy and chemotherapy in the management of local-regionally advanced vulvar cancer. Int J Radiat Oncol Biol Phys 26 (5): 809-16, 1993.
- Thomas G, Dembo A, DePetrillo A, et al.: Concurrent radiation and chemotherapy in vulvar carcinoma. Gynecol Oncol 34 (3): 263-7, 1989.
- Eifel PJ, Klopp AH, Berek JS, et al.: Cancer of the cervix, vagina, and vulva. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 1171-1210.
Tratamiento del cáncer de vulva en estadio IVB
Opciones de tratamiento del cáncer de vulva en estadio IVB
No hay un abordaje de tratamiento estándar del cáncer de vulva en estadio IVB.
El tratamiento local se debe personalizar según la extensión de la enfermedad local y metastásica.
No hay una quimioterapia estándar para la enfermedad metastásica, y los informes sobre el uso de esta modalidad son esporádicos.[1] Sin embargo, se ha estudiado el uso de la quimioterapia a partir de la extrapolación de los regímenes que se usan para los cánceres de ano y cuello uterino. Estos regímenes incluyen diferentes combinaciones de fluorouracilo, cisplatino, mitomicina o bleomicina.[1,2,3] Debido que muchas pacientes con cáncer de vulva avanzado o recidivante son de edad avanzada o tienen comorbilidades, la tolerabilidad farmacológica es un aspecto importante durante la administración de estos fármacos.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Referencias:
- Eifel PJ, Klopp AH, Berek JS, et al.: Cancer of the cervix, vagina, and vulva. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 1171-1210.
- van Doorn HC, Ansink A, Verhaar-Langereis M, et al.: Neoadjuvant chemoradiation for advanced primary vulvar cancer. Cochrane Database Syst Rev 3: CD003752, 2006.
- Cormio G, Loizzi V, Gissi F, et al.: Cisplatin and vinorelbine chemotherapy in recurrent vulvar carcinoma. Oncology 77 (5): 281-4, 2009.
Tratamiento del cáncer de vulva recidivante
Opciones de tratamiento del cáncer de vulva recidivante
Las opciones de tratamiento del cáncer de vulva recidivante son las siguientes:
- Extirpación local amplia con radioterapia o sin esta, en pacientes con recidiva local.
- Vulvectomía radical y exenteración pélvica en pacientes con recidiva local.
- Radioterapia y quimioterapia citotóxica sincrónicas con cirugía o sin esta.[1]
El tratamiento y el desenlace dependen del sitio y la extensión de la recidiva.[2] A veces se considera la extirpación radical de la recidiva localizada cuando es técnicamente posible.[3] En algunas pacientes se usa la radioterapia paliativa. El uso de radioterapia, con o sin quimioterapia, produce periodos sin enfermedad prolongado en determinadas pacientes con una recidiva local pequeña.[1,4,5] Cuando la recidiva local se produce después de 2 años del tratamiento primario, el uso de radioterapia y cirugía a veces produce una tasa de supervivencia a 5 años superior al 50 %[6,7]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Referencias:
- Russell AH, Mesic JB, Scudder SA, et al.: Synchronous radiation and cytotoxic chemotherapy for locally advanced or recurrent squamous cancer of the vulva. Gynecol Oncol 47 (1): 14-20, 1992.
- Piura B, Masotina A, Murdoch J, et al.: Recurrent squamous cell carcinoma of the vulva: a study of 73 cases. Gynecol Oncol 48 (2): 189-95, 1993.
- Hopkins MP, Reid GC, Morley GW: The surgical management of recurrent squamous cell carcinoma of the vulva. Obstet Gynecol 75 (6): 1001-5, 1990.
- Miyazawa K, Nori D, Hilaris BS, et al.: Role of radiation therapy in the treatment of advanced vulvar carcinoma. J Reprod Med 28 (8): 539-41, 1983.
- Thomas G, Dembo A, DePetrillo A, et al.: Concurrent radiation and chemotherapy in vulvar carcinoma. Gynecol Oncol 34 (3): 263-7, 1989.
- Podratz KC, Symmonds RE, Taylor WF, et al.: Carcinoma of the vulva: analysis of treatment and survival. Obstet Gynecol 61 (1): 63-74, 1983.
- Shimm DS, Fuller AF, Orlow EL, et al.: Prognostic variables in the treatment of squamous cell carcinoma of the vulva. Gynecol Oncol 24 (3): 343-58, 1986.
Actualizaciones más recientes a este resumen (02 / 29 / 2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes incorporados en este resumen a partir de la fecha arriba indicada.
Información general sobre el cáncer de vulva
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2024 (se citó a la American Cancer Society como referencia 3).
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de vulva. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de vulva son:
- Fumiko Chino, MD
- Marina Stasenko, MD (New York University Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de vulva. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/vulva/pro/tratamiento-vulva-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como "estándar" o "en evaluación clínica". Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.
Última revisión: 2024-02-29

